
2022年5月23日,我室汪贻广研究员、张强教授团队在纳米领域顶级期刊Nature Nanotechnology在线发表了最新研究成果“A pyroptosis nanotuner for cancer therapy”(细胞焦亡纳米调控器用于肿瘤治疗)。
细胞焦亡(Pyroptosis)是一种新近发现的细胞程序性坏死模式,在病原体感染、动脉粥样硬化、器官衰竭和肿瘤治疗等多种病生理过程中都具有重要作用。研究发现,很多化疗药物和无机纳米颗粒可以诱导不可控的细胞焦亡,导致严重的毒副作用和生物安全隐患。因此,迫切需要发展可控的且能特异性诱导肿瘤细胞焦亡的纳米药物用于癌症治疗。纳米药物主要以内吞方式入胞,经历内吞体成熟过程最终进入溶酶体。近年来,虽然已有不少纳米药物能通过靶向溶酶体诱导不同的程序性细胞死亡,但是内吞体成熟通路的各个阶段对纳米药物激活细胞死亡信号通路的影响和调控效应仍未可知。
鉴于此,汪贻广研究团队基于课题组发展的pH超敏感(ultra-pH-sensitive, UPS)纳米技术平台,在国际上率先建立了一系列不同pH转变点(pHt 5.0–7.0)的纳米药物(ANPS),能够对细胞内早期内吞体-晚期内吞体-溶酶体通路进行多达10个阶段的划分,每个阶段pH差异仅0.2个单位。通过ANPS纳米技术,该团队成功地将纳米药物(活性氧)精准靶向递送至特定阶段的内吞细胞器,并揭示内吞体成熟过程对ROS应激所诱导的信号通路及细胞杀伤效应的影响。
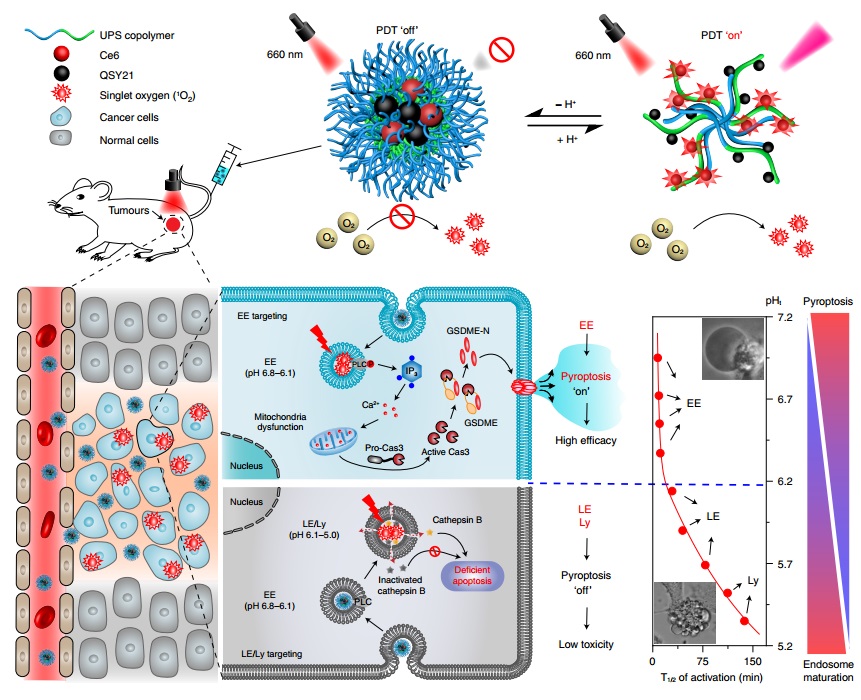
采用该项技术,汪贻广研究团队在国际上首次发现了细胞内吞成熟过程能够时空操控纳米药物诱导的细胞死亡信号通路及细胞杀伤效应,并系统阐明了早期内吞体靶向的活性氧通过特异性激活内吞体膜上的磷脂酶C信号通路和下游的Caspase3/GSDME信号通路,触发高效的肿瘤细胞焦亡;而靶向递送至晚期内吞体和溶酶体阶段的活性氧则通过经典的溶酶体膜渗透性增加,引起低效率的细胞凋亡模式。这种通过内吞体成熟过程调控细胞死亡模式和杀伤效应的焦亡纳米调控器在十多种肿瘤细胞上具有良好的普适性。相对于晚期内吞体和溶酶体靶向的纳米颗粒,早期内吞体靶向的纳米粒在体外和体内的抑瘤效果分别能提升40倍和20倍,在多种皮下/原位肿瘤模型上实现了安全高效的肿瘤治疗。该项研究为基于细胞焦亡纳米药物的合理设计和内吞体信号通路的精准靶向递送策略奠定基础。
北京大学药学院汪贻广研究员、张强教授和系统生物医学研究所游富平研究员为本文的通讯作者,北京大学药学院陈斌龙博士(博士后创新人才支持计划)为论文的第一作者,北京大学药学院天然药物及仿生药物国家重点实验室为第一单位。论文工作得到国家重点研发计划项目、国家自然科学基金以及北京市自然科学基金项目的资助。
论文链接:https://www.nature.com/articles/s41565-022-01125-0
【汪贻广研究员简介】

汪贻广,北京大学研究员、博士生导师,药学院药剂学系主任、天然药物及仿生药物国家重点实验室PI。主要从事智能纳米药物递送及疾病诊疗研究,取得了一系列创新性成果,以第一作者或通讯作者在Nat. Mater.、Nat. Nanotech.、Nat. Commun.、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Adv. Mater.、Adv. Funct. Mater.、Adv. Sci.、Nano Lett.等国际著名期刊上发表高水平学术论文50余篇。作为负责人获得国家自然科学基金“优秀青年科学基金”、北京市自然基金“杰出青年科学基金”、国家重点研发计划等资助。先后获得2015年中国药学会-中恒青年药剂学奖、2017年中国药学会-赛诺菲青年生物药物奖。目前担任中国药学会药剂学专委会委员、中国药学会纳米药物专委会委员等。
【张强教授简介】

张强,北京大学药学院教授,博士生导师。张强教授系北京大学博雅特聘教授,分子药剂学与新释药系统北京市重点实验室主任,教育部创新团队负责人,中国药学会常务理事,中国药学会纳米药物专业委员会副主任委员,国家药典委药制专业委员会副主任,Acta Pharm. Sinica B副主编,Adv. Drug Deliver. Rev.和 J. Control. Releas编委等。长期从事纳米药物研究,在Nat. Nanotech.、Nat. Commun.、J. Extracellular Vesicles、Adv. Funct. Mater.、Nano Today、ACS Nano、Nano Lett.、Adv. Drug Deliver. Rev.、Biomaterials、J. Control. Release等发表300多篇SCI论文。负责完成创新制剂研究30余项,申请国内外发明专利50多项,开发上市多个新型释药系统,产生重大经济与社会效益。获多项国家与省部级科技成果奖。
(编辑:宋书香)