2024年9月7日,我室汪贻广教授在国际著名期刊Nature Communications 在线刊登了最新研究成果“Tuning nanoparticle core composition drives orthogonal fluorescence amplification for enhanced tumour imaging”(通过调控纳米颗粒核心组分实现正交荧光信号放大以增强肿瘤成像)。

肿瘤的精准检测和边界识别对于成功的外科手术至关重要,荧光引导手术可以帮助医生实时识别肿瘤边界。然而,现有的荧光探针由于非特异性作用机制,常常导致成像对比度低。而靶向肿瘤细胞表面受体的成像探针,虽然提高了特异性,但其设计的“始终开启”模式导致高背景信号,影响了成像效果。为了解决这一问题,该实验室开发了能够响应肿瘤微环境的“可激活”荧光探针。这类探针在血液中保持荧光关闭状态,只有在肿瘤环境中激活,显著减少背景信号并提升成像对比度。然而,目前探针在肿瘤细胞内的内化效率不足,信号放大不充分,因此亟需进一步提升内化效率和特异性激活能力,以实现更精准的肿瘤成像。
该研究报道了一系列通过非离子化单体调控纳米粒核心结构的新一代pH超敏感纳米探针(HUNPs),该探针通过肿瘤蓄积与内吞,实现了肿瘤荧光信号的正交放大。通过调节纳米颗粒内核疏水性组分的种类与比例,探针的细胞结合与内化能力大幅度增强,从而显著放大了pH诱导的荧光信号。基于此策略,研究人员筛选出荧光探针iP5B5-ICG,其在多种肿瘤模型中展示了高选择性和高灵敏度的检测能力,为提升纳米药物的细胞内生物利用率以及改善成像与治疗效果提供了新的方法。
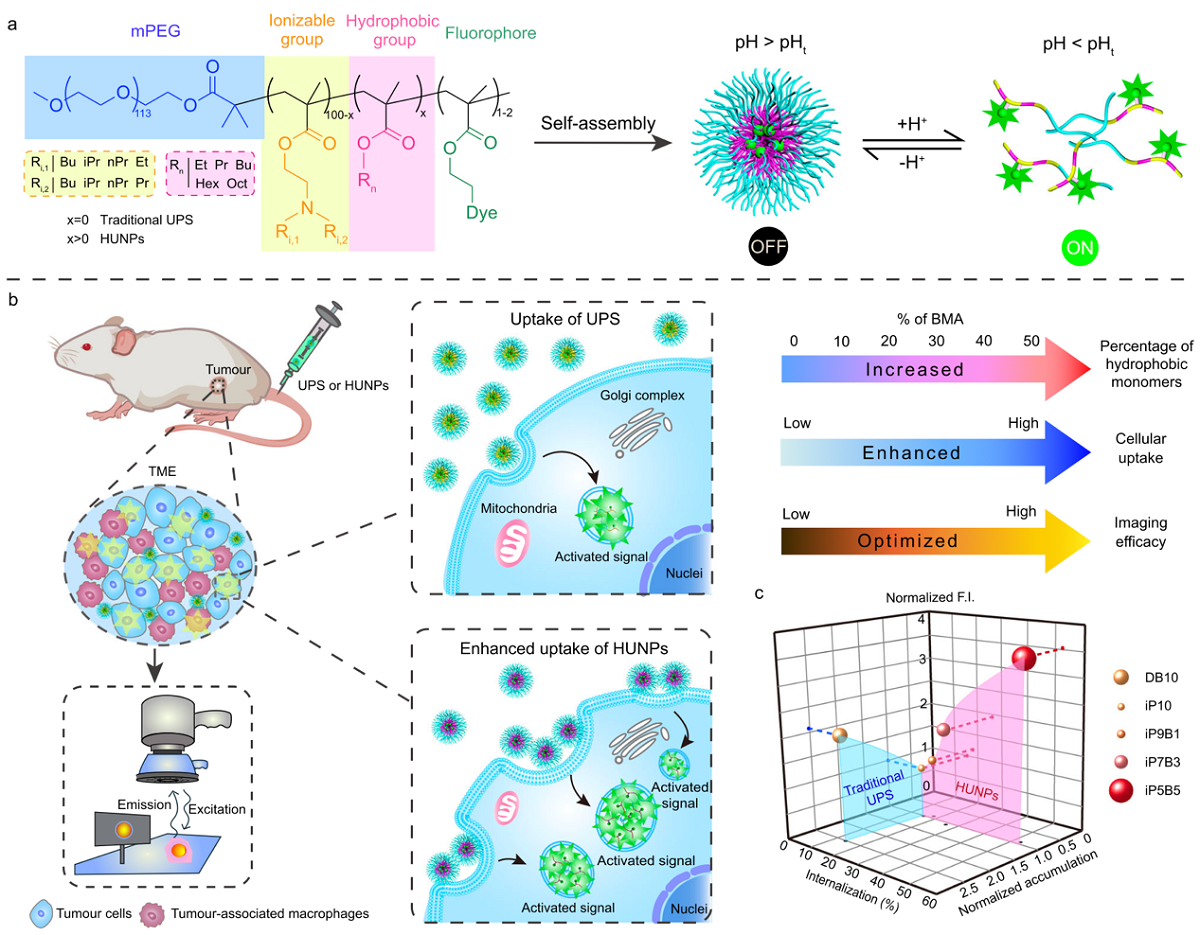
该研究首先合成与表征了一系列新型pH超敏感纳米探针HUNPs,并通过比率成像方法,揭示了纳米颗粒内核结构变化对成像规律与机理的影响。结果显示,当内核非离子化亲水单体比例增加,纳米粒的血液清除速度增加,肿瘤蓄积降低,导致肿瘤成像效果降低;相反,随着非离子化疏水单体比例增加,纳米颗粒的细胞内化效率显著提高,成像效果大幅提升。调控核心组分的HUNPs探针与第一代探针相比,其与细胞相互作用的效率提高了10倍以上,肿瘤组织中的探针内化效率高达50%。这一发现揭示了纳米粒的内核组成在增强纳米生物相互作用中的关键角色。
研究团队进一步筛选了含有不同烷基碳数的非离子化单体,最终发现,内核中添加50%甲基丙烯酸丁酯(BMA)的探针展现出最佳的肿瘤成像效果。相比临床使用的游离ICG,其对应探针iP5B5-ICG探针的肿瘤成像效果显著提升,在注射48小时后,iP5B5-ICG组的信号强度是游离ICG组的91倍,成像对比度提升9.4倍。此外,iP5B5-ICG在多种肿瘤模型中表现出高选择性和高灵敏度的成像效果,并能以极高的对比度和分辨率精确描绘恶性病灶与健康组织的边界,为肿瘤荧光成像引导手术的发展提供了有力支持。
北京大学药学院汪贻广教授为研究论文的通讯作者。北京大学药学院2017级六年制学生潘美洁(现在宾夕法尼亚大学攻读博士学位)为论文的第一作者。北京大学药学院天然药物及仿生药物全国重点实验室为第一单位。该项研究得到国家自然科学基金、国家重点研发计划项目的支持。
论文链接:https://www.nature.com/articles/s41467-024-52029-7
【汪贻广教授简介】

汪贻广,教授、博士生导师、北京大学药学院副院长、药剂学系主任、天然药物及仿生药物全国重点实验室PI。主要从事智能纳米药物递送及疾病诊疗研究,取得了一系列创新性研究成果,以第一作者或通讯作者在Nat. Mater.、Nat. Nanotechnol.、Nat. Commun.、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.等国际著名期刊上发表高水平学术论文60余篇。获得国家海外高层次青年人才、国家杰出青年科学基金、国家优秀青年科学基金、北京杰出青年科学基金等。