2024年06月25日,学术期刊 J. Am. Chem. Soc.在线刊登了我室董甦伟研究员团队最新研究成果“Investigation of N-Glycan Functions in Receptor for Advanced Glycation End Products V Domain through Chemical Glycoprotein Synthesis”(通过化学糖蛋白合成研究晚期糖化终产物受体V结构域中的N-糖功能)。

糖基化是生命体中最常见的翻译后修饰之一,在蛋白质质量控制和稳定以及细胞粘附、识别和信号传递中发挥着重要作用。人类在分子水平上对聚糖的功能依然缺乏了解,最重要的原因之一便是自然界生物合成的糖蛋白具有结构上的微观不均一性。化学合成能够制备均质的糖蛋白,从而有助于克服这些挑战。董甦伟团队长期致力于蛋白质化学合成和糖基化功能探究。在前期工作中,他们利用化学合成与化学酶法结合的策略,合成得到多种具有均一糖基化修饰的糖蛋白或糖多肽,包括人白细胞介素-17A(J. Am. Chem. Soc. 2021, 143, 2846–2856)、β淀粉样多肽(J. Am. Chem. Soc. 2021, 143, 20216–20223)、SynGAP蛋白(Nat. Chem. 2022, 14, 831–840)、药物多肽PTH(CCS Chem. 2023, 5, 1623-1634.)等,发现聚糖链在调控蛋白质参与相变、抑制蛋白质聚沉、提高多肽的半衰期等方面发挥重要功能。
在以上工作基础上,董甦伟团队近期关注到了一类新的糖基化蛋白——晚期糖化终产物受体(Receptor for advanced glycation end product, RAGE)。RAGE与诸多炎症相关途径和各种慢性疾病密切相关。前人研究表明,RAGE的V结构域(RAGE-VD)中有能够影响配体蛋白结合的N-糖基化修饰,但受限于无法获得均质糖蛋白样品,糖修饰位点、糖链结构如何调控RAGE功能的机制尚不明确。董甦伟团队采用化学-酶法相结合的策略,以化学合成控制糖基化位点、酶法改造糖链结构,成功制备得到RAGE-VD及其在特定位点(Asn3)精准N-糖基化修饰的五种蛋白糖型。对这些均质样品的研究表明:与其它糖型相比,Asn3位点具有末端α2,6-唾液酸的N-糖链能够显著增强RAGE-VD与配体蛋白HMGB1的结合,并且在RAGE 高表达细胞系中更强地抑制HMGB1诱导的炎性反应。进一步的氢/氘交换质谱分析揭示了在HMGB1结构中,存在一个此前未见报道的N-糖链唾液酸相关互作区域。该工作建立了高效合成均质糖基化修饰RAGE-VD 的方法,通过构效关系研究阐释了N-糖链促进其修饰蛋白和非经典糖结合蛋白相互作用的新机制,从而为下一步通过糖链结构改造发现HMGB1的高亲合力结合蛋白提供了重要线索。
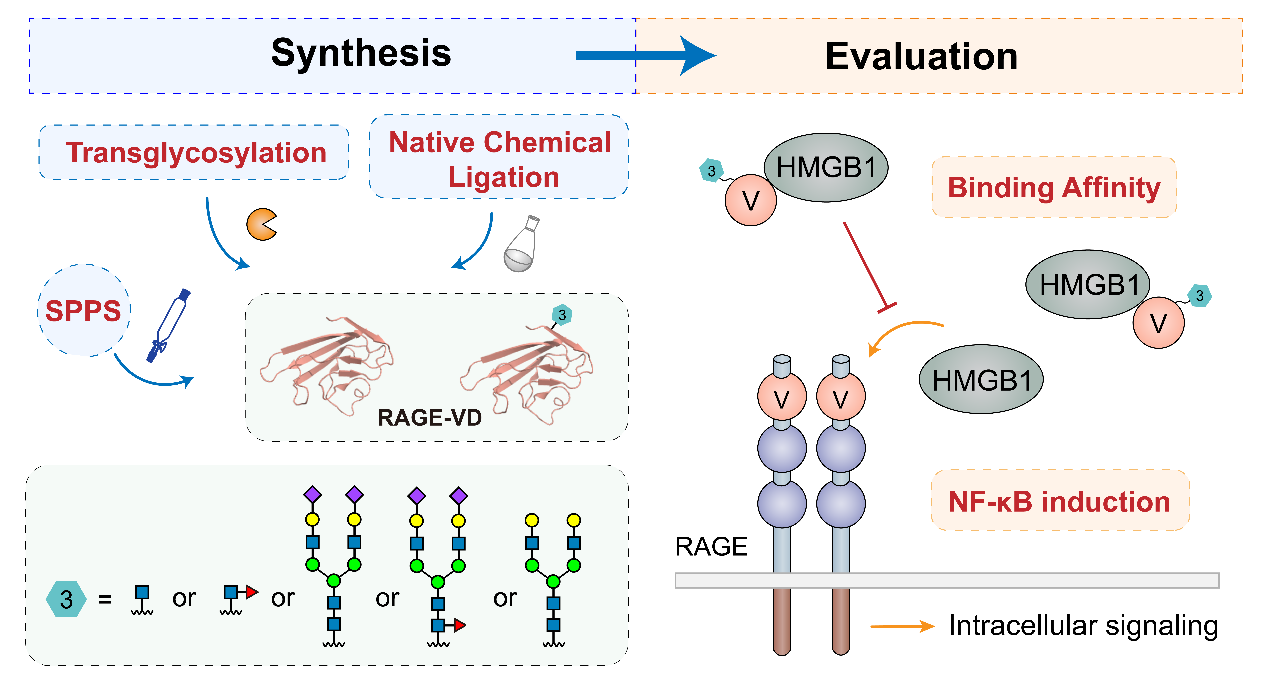
通过化学糖蛋白合成研究晚期糖化终产物受体V结构域中的N-糖功能
(图片基于J. Am. Chem. Soc.原图绘制)
北京大学董甦伟研究员为该研究论文的通讯作者。北京大学药学院2019级直博生董伟东为论文的第一作者,团队成员阳星月、李信宇、卫晟、安传敬博士、张俊博士为该研究做出了重要贡献。天然药物及仿生药物全国重点实验室仪器平台施晓萌老师为该研究提供了重要帮助。该项研究得到国家自然科学基金重大研究计划的支持。
论文链接:https://pubs.acs.org/doi/10.1021/jacs.4c01413
【作者简介】

董伟东,北京大学2019级直博生,研究兴趣为糖蛋白化学生物学;在学期间以第一作者或共同作者身份在J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、ACS Catal.、Chin. J. Chem.、Bioorg. Chem.、Fundam. Res.、J. Carbohydr. Chem.等杂志上发表学术论文7篇;曾获研究生国家奖学金、北京大学三好学生标兵等荣誉和奖励。

董甦伟,博士,北京大学研究员、博士生导师,药学院化学生物学系主任、天然药物及仿生药物全国重点实验室PI。入选国家级人才计划青年项目。长期致力于蛋白质化学合成和糖基化功能研究、多肽及蛋白药物的研究与发现,以第一作者或通讯作者身份在Science、Nat. Chem.、Nat. Commun.、Proc. Natl. Acad. Sci. U.S.A、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Adv. Sci.等学术刊物发表多篇学术论文;作为负责人获国家自然科学基金优秀青年基金项目、北京市自然科学基金杰出青年基金项目等资助。先后获得 “中国药学会-施维雅”青年药物化学奖、中国化学会糖化学青年学者奖、“惠永正糖科学奖”青年创新奖等奖励。