2024年12月20日,我室李鲜婵团队在Journal of the American Chemical Society杂志刊登了题为“Single-Vesicle Electrochemistry in Fresh Brain Slices Enables In-situ Quantification of Vesicular Monoamine”(单囊泡电化学用于新鲜脑切片神经囊泡单胺类递质的原位定量检测)的研究工作。

胞吐是神经元之间化学信号转导的关键过程,其中神经囊泡与神经递质是执行这一过程的主要亚细胞器与化学分子。因此,定量监测神经囊泡内递质的储存和胞吐释放过程,对于阐明化学信号转导和理解中枢神经系统神经元的异质性具有重要意义。基于囊泡尺寸小(纳米)与神经递质胞吐释放时间短(毫秒),单细胞安培法(single-cell amperometry,SCA)由于超高的时空分辨率与定量分析能力已被证明是研究囊泡神经递质胞吐释放的强大工具。针对单囊泡递质储存定量难的问题,该团队早期建立了神经囊泡原位电化学计数法(intracellular vesicle impact electrochemical cytometry,IVIEC)攻克了此难题。然而受方法学的限制,IVIEC和SCA的联用主要局限于培养的神经模型细胞与类器官,难以全面反映动物行为、生理及病理机制与囊泡神经递质动态变化之间的关联。
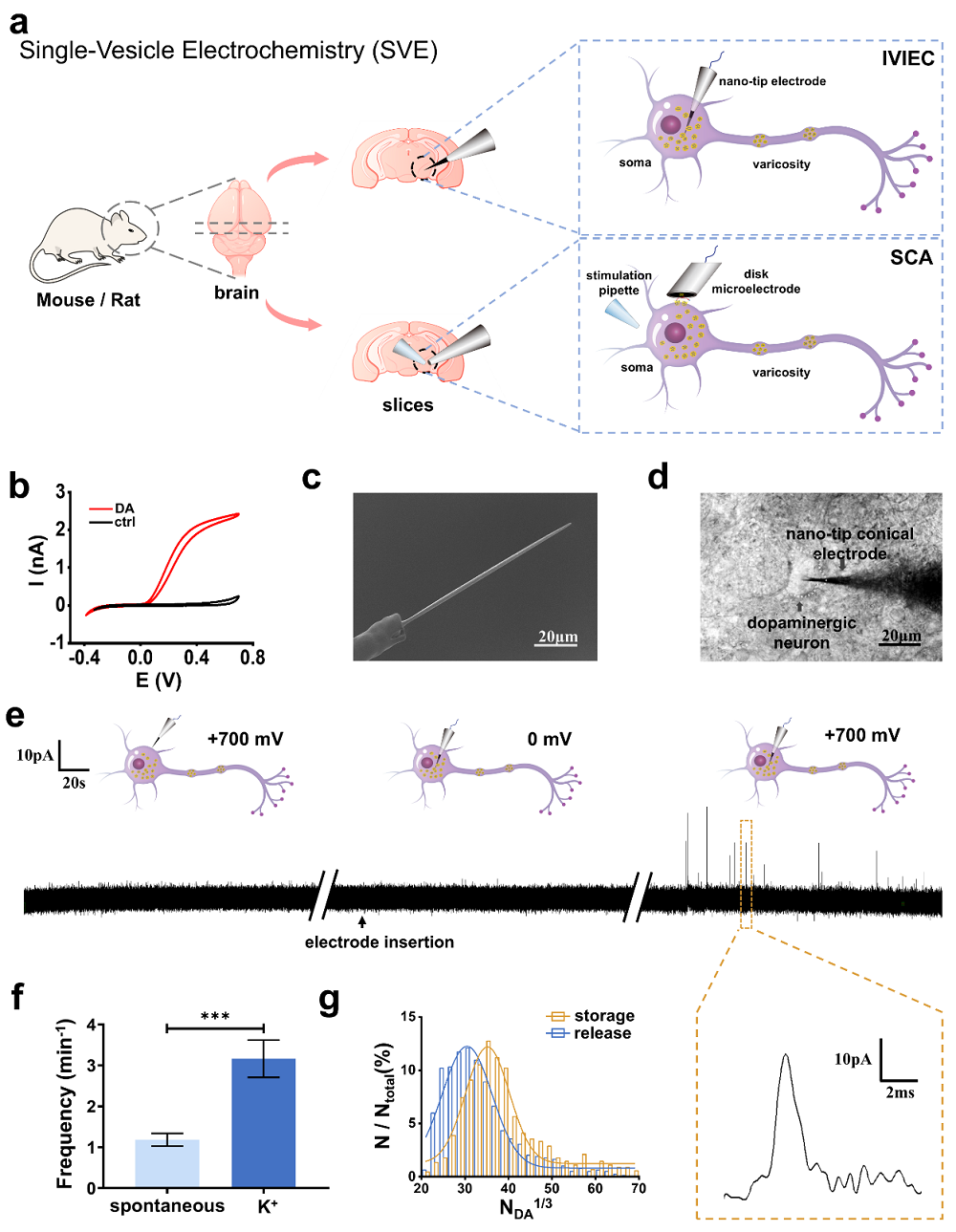
针对这些瓶颈,该研究团队使用新鲜脑组织作为神经元的天然载体,保留了神经元原有的生物微环境和生理连接,开创性地构建了专门针对新鲜脑组织切片设计的IVIEC分析方法,用于检测单个囊泡内神经递质的储存。将其与SCA相结合共同揭示了神经化学信号转导机制的复杂性。通过使用 L-3,4-二羟基苯丙氨酸与利血平进行药物干预,有力地验证了脑组织单囊泡电化学分析方法的稳定性和可靠性。随后研究团队将这一方法应用到帕金森症动物模型研究中,首次发现了多巴胺神经元囊泡内神经递质的储存量显著下降,同时胞吐释放过程受到抑制,表现为神经递质胞吐释放量的显著减少、释放动力学变慢,这为帕金森症的潜在发病机制提供了启示。此外,该研究还深入探讨了不同脑区(背侧纹状体、腹侧被盖区、蓝斑核和中缝核)其它神经递质(去甲肾上腺素,五羟色胺)单囊泡储存与胞吐量子释放的异质性。
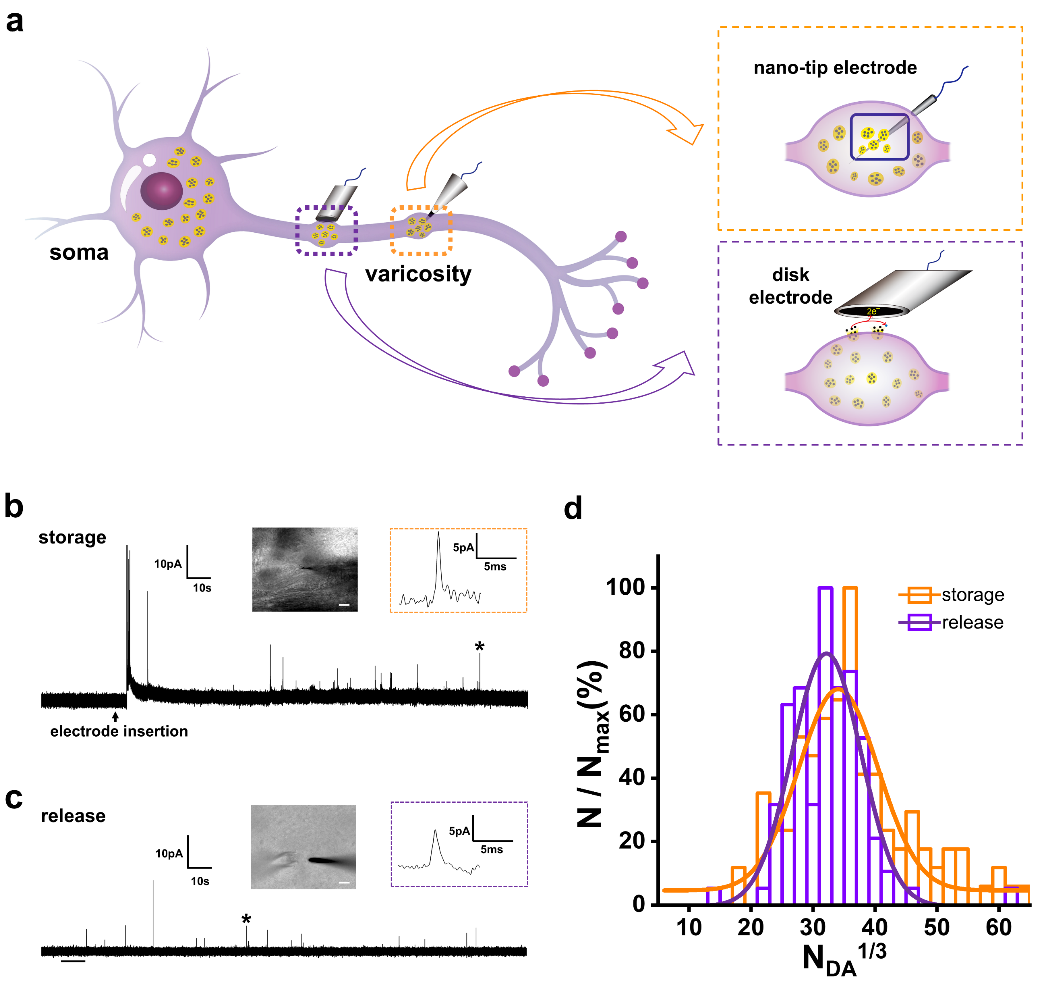
综上所述,该研究开发了一种具有广泛应用前景的组织单囊泡电化学分析平台,为在新鲜脑组织中单囊泡水平上研究化学信号传递的生物学过程和神经系统疾病的紊乱机制探索提供了一种新策略。
北京大学药学院李鲜婵研究员为研究论文的通讯作者,北京大学药学院2022级博士研究生刘玉影为研究论文的第一作者,北京师范大学毛兰群教授团队为该研究提供了重要帮助。该工作得到了国家自然科学基金、北京市自然科学基金、国家重点研发计划与国家海外高层次人才计划“青年项目”等项目的支持。
论文链接:https://doi.org/10.1021/jacs.4c06572
【作者简介】

李鲜婵,博士,北京大学药学院、天然药物及仿生药物全国重点实验室PI、研究员、博士生导师。入选海外高层次青年人才和第三批“全国高校黄大年式教师团队”核心成员。课题组长期聚焦于神经化学信号转导的分析、神经囊泡的分析化学、重大脑疾病发病机制及药物作用机制等方面研究。担任Talanta编委。近年来在Nat. Rev. Chem.、JACS、Angew. Chem. Int. Ed.、Acc. Chem. Res.、Anal. Chem.、ACS Nano等国际学术期刊发表多篇研究论文。获得海外高层次青年项目、国家自然科学基金、科技部重点研发计划和北京市自然科学基金重点项目等项目支持。

刘玉影,北京大学药学院药物分析学系2022级博士研究生,研究方向为单囊泡电分析探究活体动物大脑神经元胞吐异质性与神经疾病。以第一作者或共同作者身份在JACS、Anal. Chem.、Talanta等杂志上发表多篇学术论文。