黄芪皂苷是一类结构特异、活性明确的中药来源天然产物。2022年,我室叶敏/乔雪团队在黄芪皂苷生物合成研究中取得了系列进展,部分成果发表在Angewandte Chemie International Edition(IF=16.8)、Plant Biotechnology Journal(IF=13.2)、Journal of Advanced Research(IF=12.8)期刊上。
一、 三萜3-/6-/2'-O-糖基转移酶AmGT8的功能表征、定向改造及催化机制

黄芪皂苷是黄芪中一类以环黄芪醇为骨架的三萜皂苷,也是传统中药黄芪的主要药效成分,具有保肝、抗病毒、保护心血管和免疫调节等药理活性。虽然总含量较高,但黄芪皂苷结构多样,且缺乏紫外吸收,分离纯化存在很大困难。采用生物合成的手段制备黄芪皂苷,是解决这一问题的有效方法。黄芪皂苷的合成途径大致分为四类反应:骨架生成、氧化/环化、糖基化、酰基化。
植物体内的糖基化反应可由糖基转移酶(GT)催化,而催化环阿屯烷型三萜的GT酶尚未报道。此外,由于三萜分子明显大于黄酮、酚酸等天然产物,三萜糖基转移酶的催化机制往往不清楚,其催化功能的改造也具有较大难度。
该研究以膜荚黄芪为研究对象,从中挖掘到第一个环阿屯烷型三萜糖基转移酶AmGT8,其催化环黄芪醇的3-OH及2-OH发生连续两步的糖基化反应,生成相应的双糖产物。通过半理性设计,首次实现了三萜类GT酶的位点选择性改造,通过单点突变,获得分别具有3-/6-/2'-O-糖基化三种不同功能的突变体A394D、A394F和T131V,将其应用于黄芪皂苷的生物合成中,并对催化机制进行了阐释。研究还发现A394位点可应用于改变其它植物GT的位点选择性,具有一定的普适性,为植物糖基转移酶的催化功能改造及黄芪皂苷的酶催化合成提供了新的思路。
上述工作于2021年12月在线发表在Angewandte Chemie International Edition(2022, 61, e202113587)上。药学院2020级博士生张梦为论文第一作者,乔雪研究员、叶敏教授为共同通讯作者。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202113587
二、系列黄芪皂苷的组合催化合成

目前从中药黄芪中报道过22种环阿屯醇型皂苷,包含14种不同的糖取代类型。包括环黄芪醇3-O-木糖/葡萄糖基化、6-O-葡萄糖基化、25-O-葡萄糖基化。部分黄芪皂苷含量很低,药理活性研究有限。
在AmGT8的基础上,该研究从黄芪中继续筛选得到多个糖基转移酶:AmGT1可催化环黄芪醇C3-OH糖基化,对UDP-Xyl有较好的选择性,能同时利用UDP-Glc等10种糖基供体,是已知供体选择性最广泛的三萜GT酶;AmGT5可催化环黄芪醇C3-OH的糖基化,但对UDP-Glc选择性更高;AmGT9可催化环黄芪醇C25-OH的糖基化,是第一个催化环阿屯烷型三萜侧链羟基的糖基转移酶。通过定点突变获得AmGT1G146V/I突变体,可专一利用UDP-Xyl。利用AmGT1/9及AmGT1G146V/S,与已报道的AmGT8及其突变体AmGT8A394F联用,实现了黄芪中13个环阿屯烷型皂苷的组合合成,转化率为22.6%~98.7%。此外,来自黄芪的糖基转移酶还可用于合成新颖黄芪皂苷、稀有或新颖的人参皂苷,为三萜皂苷的生物催化提供了工具。部分糖基化产物的保肝活性或抗新冠病毒活性明显增强。
以上工作于2022年12月在线发表在Plant Biotechnology Journal上。药学院2018级博士生陈宽(已毕业)、2020级博士生张梦、2020级直博生高伯函为论文共同第一作者,乔雪研究员、叶敏教授为共同通讯作者。
原文链接:https://onlinelibrary.wiley.com/doi/10.1111/pbi.13983
三、黄芪氧鲨烯环化酶的催化功能及催化机制
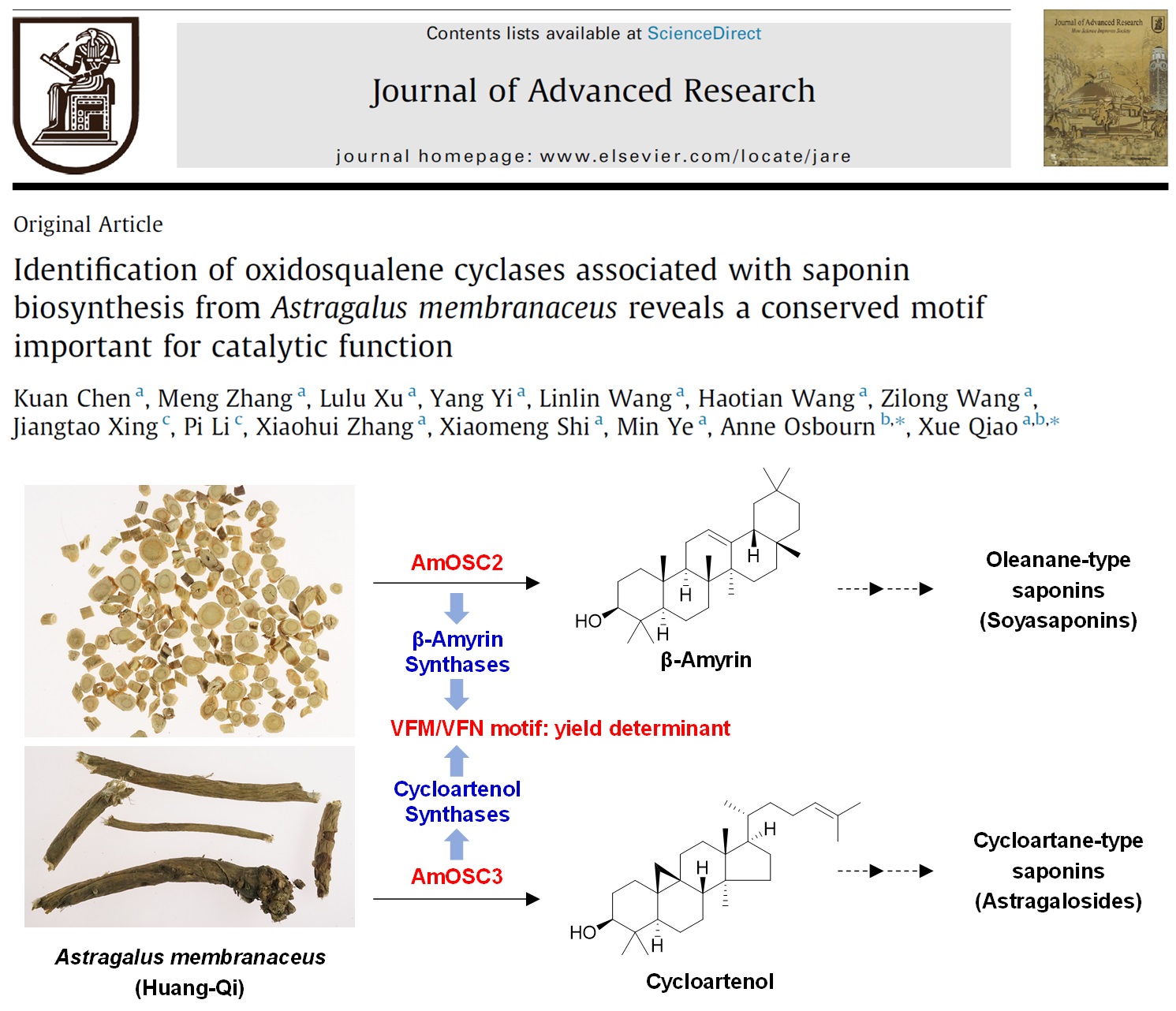
多数豆科植物都含有β-香树脂烷型三萜皂苷,但仅有黄芪等少数植物以环阿屯烷型三萜为主要成分。为阐明黄芪中环阿屯烷型三萜的合成机制,该研究从膜荚黄芪中筛选得到了2条OSC基因,AmOSC2和AmOSC3。通过在烟草和酵母中的异源表达,鉴定了AmOSC3和AmOSC2分别为环阿屯醇合酶和β-香树脂醇合酶;采用过表达及RNAi证实它们在黄芪体内分别参与环阿屯烷型皂苷(如黄芪皂苷)和齐墩果烷型皂苷(如大豆皂苷I)的生物合成。同时,该研究还发现了β-香树脂醇/环阿屯醇合酶的氨基酸保守区VFM/VFN,通过对不同物种的10条OSC酶的定点突变,证实了该保守区对OSC催化功能有重要作用,是决定产率的关键因素。该研究鉴定了参与黄芪皂苷合成首步次生代谢反应的OSC酶,并为OSC功能改造提供了新的关键保守位点。
以上工作于2022年3月在线发表在Journal of Advanced Research上。药学院2018级博士生陈宽(已毕业)为论文第一作者,药学院乔雪研究员、英国约翰英纳斯研究中心Anne Osbourn教授为共同通讯作者。
原文链接:https://www.sciencedirect.com/science/article/pii/S2090123222000765
以上工作得到国家自然科学基金(82122073, 81973448, 81725023)、北京市自然科学基金(JQ18027)等支持。同时感谢天然药物及仿生药物国家重点实验室仪器平台师晓萌、张晓辉老师,中国科学技术大学李福东副教授,瑞典乌普萨拉大学李俊豪博士、Ågren Hans 教授,中国科学院昆明植物研究所刘海洋教授,以及赛默飞世尔科技有限公司邢江涛、李丕、柴瑞平、崔宇老师的重要帮助。
【通讯作者简介】

乔雪,北京大学药学院研究员,生药学专业博士生导师。北京大学博士,英国约翰英纳斯中心访问学者。入选国家自然科学基金委优秀青年科学基金、北京市杰出青年科学基金、中国科协青年人才托举工程。研究兴趣为中药分析新方法及植物生物合成。在Proc. Natl. Acad. Sci. U. S. A.、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Nat. Prod. Rep.等期刊发表第一或通讯作者SCI论文90余篇,被引用1500余次。目前担任Fitoterapia期刊副主编。

叶敏,北京大学药学院教授,博士生导师。入选国家自然科学基金委杰出青年基金、优秀青年基金、教育部新世纪优秀人才、北京市科技新星等人才计划。主要研究领域为中药药效物质、天然产物生物合成与生物催化,关注甘草等常用中药及其活性成分的研究。发表SCI论文200余篇,被引用5000余次,获批专利10项。目前担任J. Ethnopharmacol.、J. Pharm. Biomed. Anal.等杂志的副主编或编委,兼任国家药典委员。
(编辑:宋书香)