2024年12月5日,我室汪贻广教授团队在国际知名学术期刊Journal of the American Chemical Society上发表了题为“Lysosome-Mitochondria Cascade Targeting Nanoparticle Drives Robust Pyroptosis for Cancer Immunotherapy”的研究工作。

与传统药物递送相比,靶向递送在临床药物治疗中具有更低的毒性和更大的治疗窗口。在过去的几十年里,研究者们更加重视将药物特异性递送到器官、组织或特定细胞中,尽管这些策略提高了药物的靶组织蓄积和靶细胞内化,但不受控制的胞内过程会导致药物被胞质稀释、胞内靶点利用率降低。现有的亚细胞靶向技术难以实现高效的体内应用,它们往往受限于小分子在体内的快速清除和广泛分布,抑或受限于纳米载体被细胞内吞后的低内体逃逸效率,以上种种因素都阻碍了亚细胞靶向递送在体内的应用。
针对以上瓶颈问题,汪贻广教授团队开发了一种模块化的酸/酶双门控纳米技术平台TAEN,通过分级响应和多次靶向过程,不仅在血液循环过程中稳定载药、在肿瘤部位中选择性蓄积,还在亚细胞水平实现了以溶酶体为出发点、进一步将药物递送至线粒体的高效级联递送。
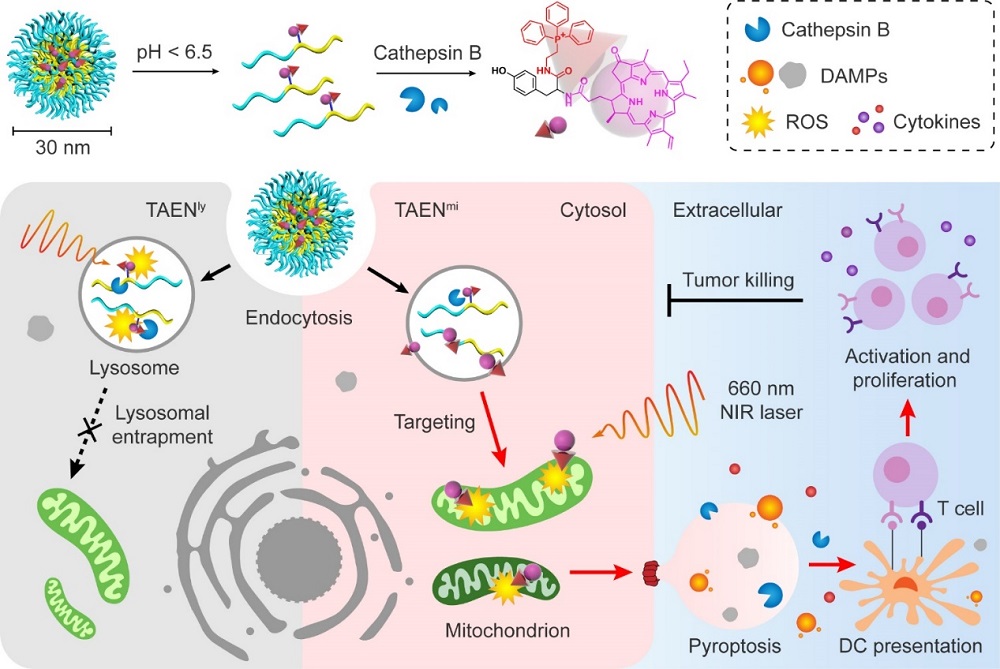
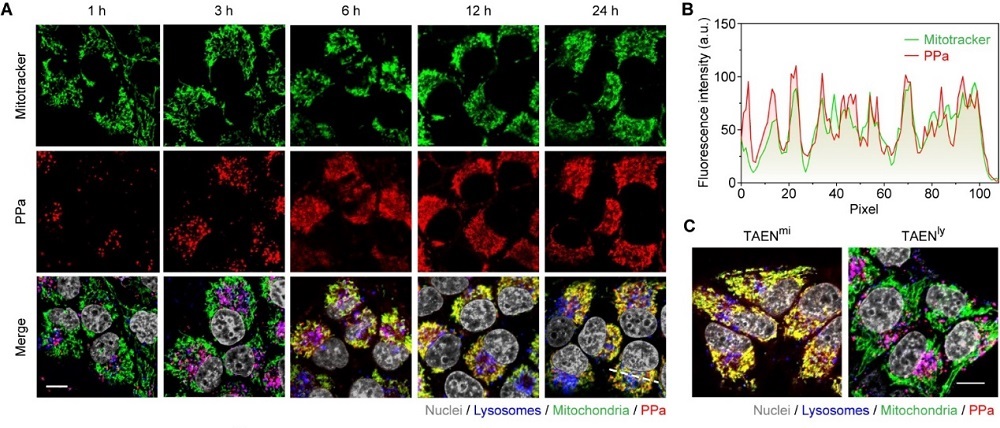
TAENmi被肿瘤细胞内化后,可以先后对内吞细胞器中的酸性和酶条件做出响应,导致线粒体靶向光敏剂药物以时间依赖的方式从纳米载体中释放。药物从载体分离后,其膜通透性大大提升,使其无需依赖内体逃逸过程,通过被动扩散即可高效富集于靶细胞器中。
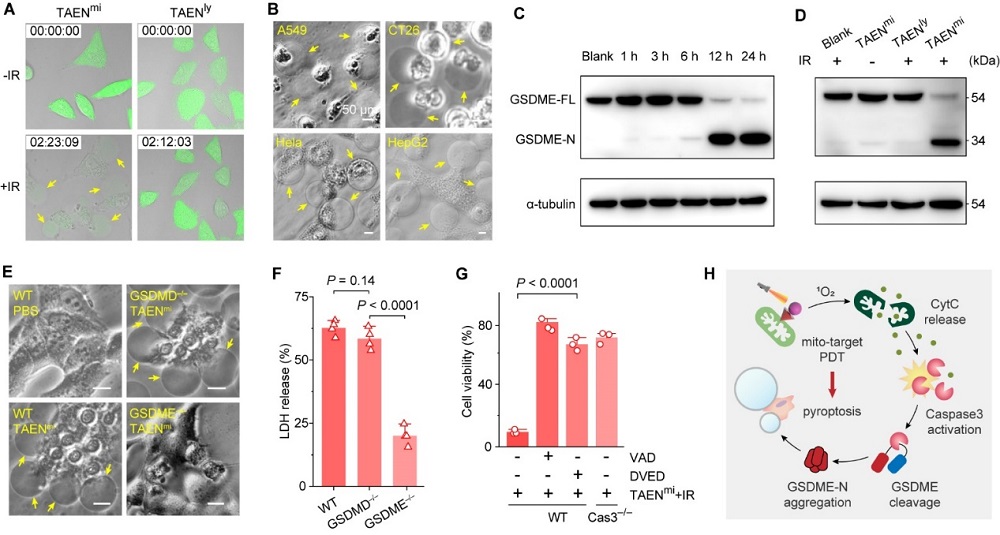
利用这种纳米技术,团队发现线粒体靶向的活性氧(ROS)应激诱导gasdermin-E(GSDME)切割并引发肿瘤细胞的焦亡,将肿瘤杀伤效率提高了30-50倍,并伴随着抗肿瘤免疫反应的激活。
综上所述,这项研究不仅提出了一种新的亚细胞靶向药物递送策略,还为细胞生物学和纳米生物学的进一步研究提供了有价值的工具。此外,这项研究进一步拓宽了pH超敏感纳米技术(UPS)在亚细胞靶向递送中的应用,具有深入开发和探索的潜力。
北京大学药学院汪贻广教授和陈斌龙副研究员为论文的共同通讯作者。北京大学药学院2022级博士研究生刘建雄、北京大学第一医院助理研究员鄢月为论文的共同第一作者。该工作得到科技部重点研发计划和国家自然科学基金等项目资助。
论文链接:https://pubs.acs.org/doi/10.1021/jacs.4c12264
【作者简介】

汪贻广,教授、博士生导师、北京大学药学院副院长、药剂学系主任、天然药物及仿生药物全国重点实验室PI。主要从事智能纳米药物递送及疾病诊疗研究,取得了一系列创新性研究成果,以第一作者或通讯作者在Nat. Mater.、Nat. Nanotechnol.、Nat. Commun.、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.等国际著名期刊上发表高水平学术论文70余篇。获得国家级人才计划青年项目、国家杰出青年科学基金、国家优秀青年科学基金、北京杰出青年科学基金等。

陈斌龙,博士,北京大学药学院副研究员,汪贻广团队Co-PI,国家博新计划及北京市青托工程入选者。长期专注于智能药物递释系统研究,发展细胞和亚细胞精准药物递释技术,高效操控生物学效应;通过解析药物递送过程中的纳米生物学机制,指导纳米药物设计。至今,以第一作者或者通讯作者身份在Nat. Nanotechnol.、Nat. Commun.、J. Am. Chem. Soc.、Nano Today等国际著名期刊发表高水平论文多篇。

刘建雄,北京大学药学院药剂学专业2022级博士研究生,研究方向为智能药物载体系统。目前以第一作者身份在J. Am. Chem. Soc.杂志发表论文,以共同作者身份在Nat. Commun.、Angew. Chem. Int. Ed.、Nano Letters等杂志上发表多篇学术论文。

鄢月,北京大学药学院2021级博士后,现为北京大学第一医院助理研究员。研究兴趣为肿瘤纳米诊疗及纳米药物的体内可视化转运机理。目前以第一作者身份在Nat. Commun.、J. Am. Chem. Soc.、Adv. Sci.等杂志上发表多篇学术论文。获得国自然青年科学基金、博士后面上基金的资助。
课题组网站:http://www.wangyiguang-group.com