近期,我室王坚成教授团队在《Journal of Controlled Release》期刊2022年第342期上发表综述文章。随着RNA药物,尤其是使用脂质纳米颗粒 (LNP)递送mRNA的新冠疫苗的成功上市,RNA药物的发展受到越来越多的关注。

由于RNA药物在填补小分子药物靶点的成药空白、精准治疗和高效性等方面表现出的良好优势,RNA药物有望为更多疾病的治疗带来曙光[1-2]。然而,与许多小分子药物和蛋白质药物不同的是,RNA分子带负电荷且对体内无处不在的核酸酶敏感,同时其作用位点大多位于胞质内[3]。因此,克服RNA递送环节的重重障碍便成为制约RNA药物应用转化的主要难点,需要设计开发高效安全的递送载体(图1)。
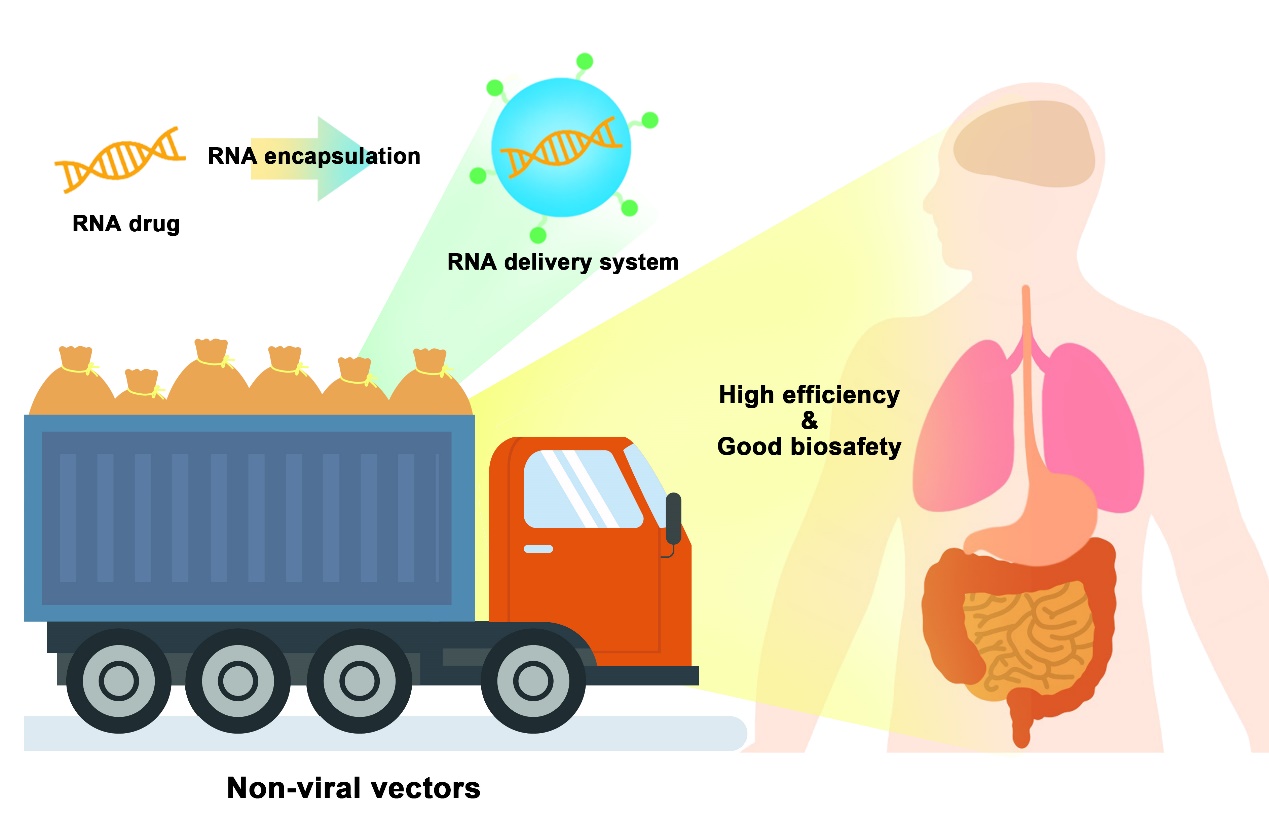
图1.非病毒载体作为“运货卡车”可高效安全地在体内递送 RNA药物
因此,该团队在这篇综述中主要关注用于RNA递送的非病毒载体在临床前研究、临床试验和市场阶段的研究进展。针对体内递送RNA药物时存在的各类生物屏障(图2),分析归纳了非病毒递送体系对各递送环节存在问题的相应解决策略,并就已有的合成和仿生类载体进行了优劣势探讨以及未来展望思考。
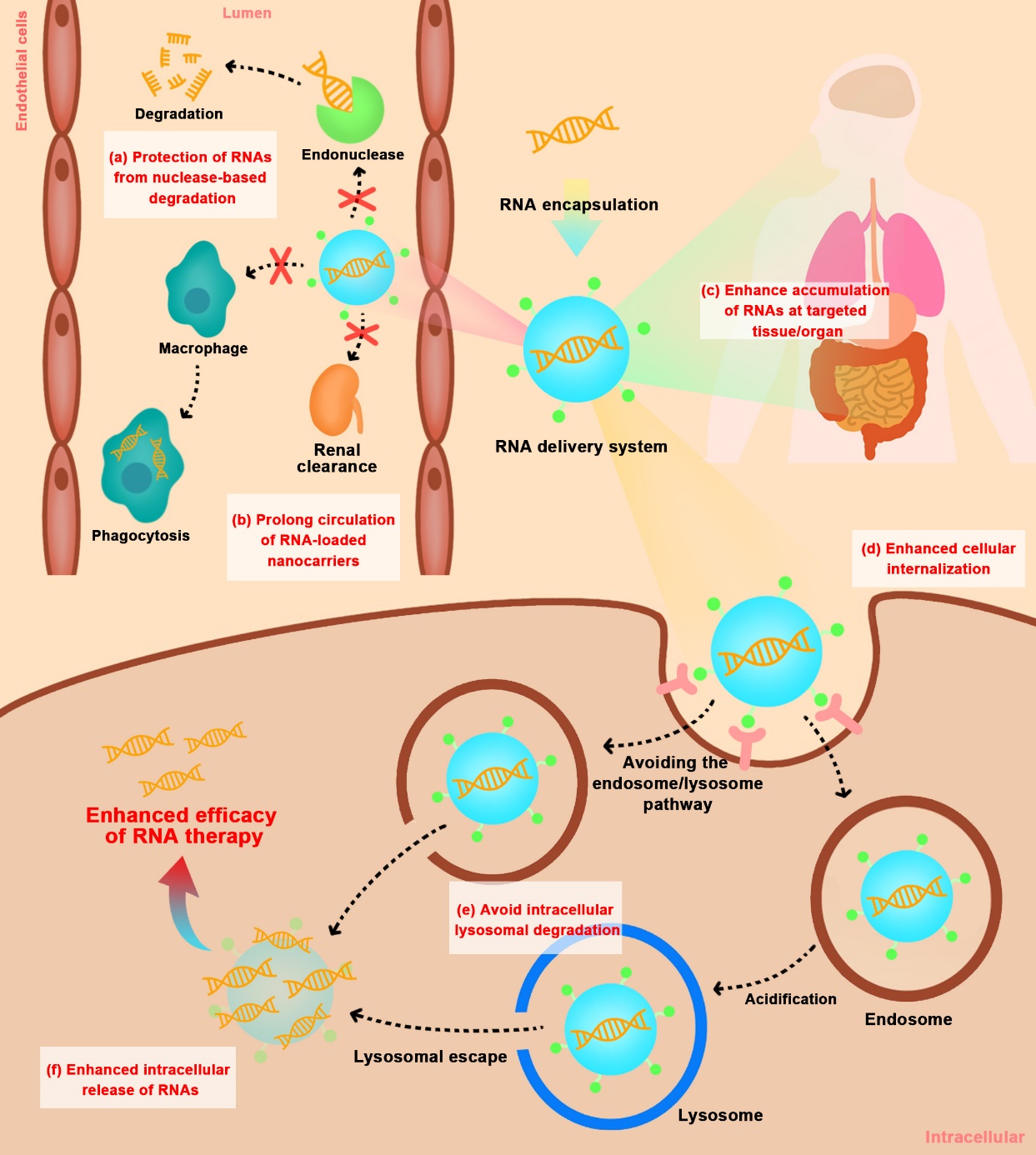
图2.使用非病毒载体在体内递送 RNA 的细胞外和细胞内屏障
本研究的亮点总结:
根据细胞内外RNA药物递送的生物屏障对非病毒载体设计进行分类;
概述了从临床前、临床试验和市场阶段的RNA药物的非病毒载体研究进展;
分别讨论了RNA药物递送的合成类和仿生类非病毒载体
在该综述中,研究人员系统回顾了已上市的RNA药物、临床实验和临床前研究的载体进展历程,对其有效保护RNA免受核糖核酸酶的降解、延长体内血液循环、促进RNA药物在特定组织中积累、增强RNA药物的细胞内化、避免胞内溶酶体降解、增强胞内释放等方面进行了综合的分析。也总结了目前研究较为瞩目的仿生类RNA药物递送系统的诸多优异特性,如良好的生物相容性、长循环特性、固有靶向性以及易编程/改造以赋予载体预期功能的特性等,并对其用于RNA药物的递送研究现状做了简单阐述。
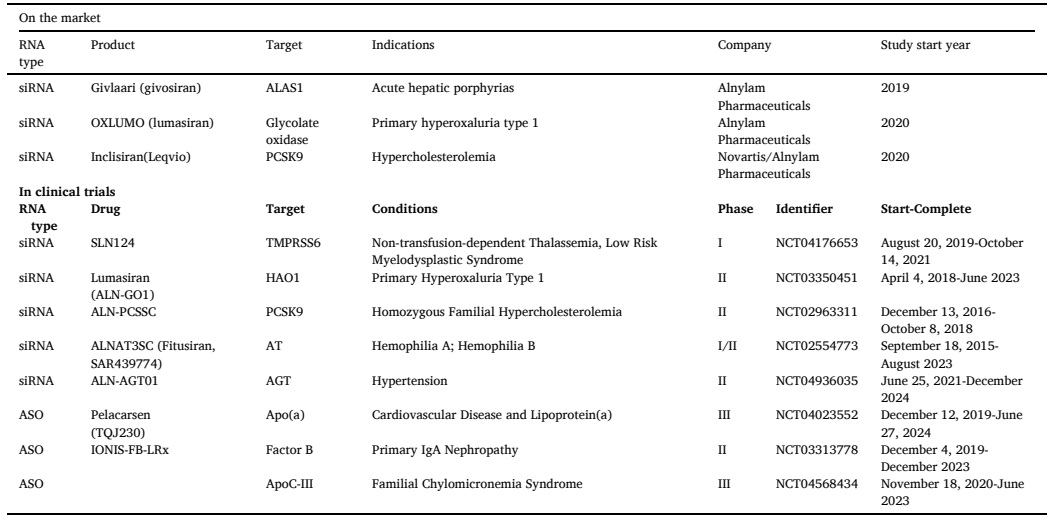
目前,已上市有9种ASO、4种siRNA、2种mRNA和1种适配体药物,其中涉及的非病毒载体递送策略主要包括脂质纳米粒(LNP)和N-乙酰半乳糖胺(GalNAc)的共价偶联。其中有三款基于LNP的RNA药物,包括 Patisiran (ONPATTRO™)、BNT162b2和mRNA-1273(如表1);三款GalNAc偶联技术的siRNA药物,包括Givosiran、Lumasiran和Inclisiran,目前在治疗肝脏相关疾病方面具有显著优势,并且还有多款该体系药物处于临床实验阶段(如表2)。
表1. 已上市RNA药物的载体处方成分
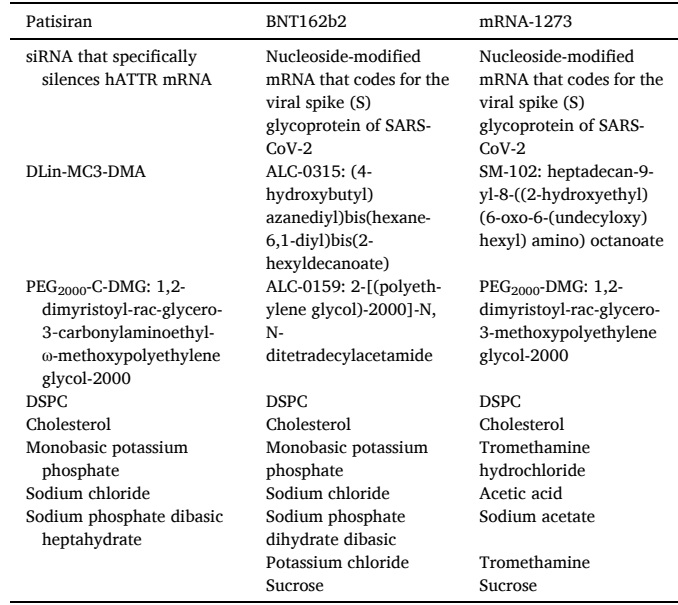
表2. 已上市和临床试验中GalNac偶联技术的RNA药物
为了进一步促进更多的RNA药物的临床转化,需要平衡考虑 RNA 递送系统的安全性和有效性。用于RNA制剂的辅料或载体材料应具有生物相容性性,以避免辅料诱导的免疫激活。此外,稳定的封装和组织/细胞特异性靶向递送系统将有利于避免 RNA药物在非靶组织和细胞中引起不必要的毒性的生物效应。同时,RNA的有效内体逃逸和可控释放也有利于提高药物的细胞内浓度,从而减少脱靶效应和免疫刺激等浓度依赖性副作用。其他可能潜在的毒性还包括备受关注的正电荷相关的血浆蛋白聚集、免疫刺激和非特异性组织积累等问题[4],PEG诱导的“加速血液清除”现象(ABC)[5],以及基于聚合物的递送系统的不可生物降解性、或者未知可降解片段诱导的体内代谢毒性等。未来仍需不断努力改进和开发成熟的递送系统策略,此外,RNA成本效益的评估、生产规模的扩大、批次间差异的控制和质量标准的制定也至关重要。
仿生载体的优势为RNA药物在体内的递送模式提供了新的见解,使得仿生递送载体成为未来的发展趋势。与集成多功能模块合成非病毒载体的复杂性相比,仿生载体可以通过引入单个内源性模块获得复合的功能特征,具有良好的循环和生物相容性,且容易通过先天获得或后天修饰获得不同的靶向性能。然而,目前市场上还没有基于仿生载体的RNA药物获批,仿生载体尚未实现临床转化的原因主要包括:异种生物成分潜在的免疫原性风险,由复杂的物质组成所引入的潜在副作用,批间差异大、规模化生产难度高等问题[6]。这些问题的解决和可用生物材料来源的进一步扩展,将推动仿生载体和RNA药物递送的发展,使得有价值的RNA药物真正造福临床患者。
【文章信息】
Yi Yan#, Xiao-Yu Liu#, An Lu, Xiang-Yu Wang, Lin-Xia Jiang, Jian-Cheng Wang*. Non-viral vectors for RNA delivery. Journal of Controlled Release 342 (2022) 241–279.
全文链接:https://doi.org/10.1016/j.jconrel.2022.01.008
【作者信息】
北京大学药学院王坚成教授为本文的通讯作者,18级博士研究生闫仪、19级直博研究生刘宵钰为本文的共同第一作者。

王坚成,北京大学药学院教授,博士生导师,药学院党委委员、北京大学宁波海洋药物研究院副院长,天然药物及仿生药物国家重点实验室PI,科技部科技创新领军人才、教育部新世纪优秀人才,北京市科技新星,中国药学会药剂专业委员会委员,北京药学会药剂专业委员会副主任委员,《中华医学百科全书药剂学分卷》副主编,国家卫健委3D打印医学应用专家委员会委员,中国医药生物技术协会纳米生物技术分会委员,中国药学会继续教育工作委员会委员。主要研究领域涵盖:生物大分子药物(蛋白多肽和siRNA)体内给药系统研究、靶向性纳米药物递送系统研究。负责主持国家自然科学基金6项,承担国家重大新药创制儿童药研发技术平台等国家级和省部级项目5项,在Nat Commun, Biomaterials, J Control Release, ACS Appl Mater Interfaces等期刊上共发表学术论文128篇,其中SCI学术论文92篇,获新药证书1项,临床批件2件,专利证书17件,主译书籍《纳米粒药物输送系统》。
【参考资料】
[1] X.M. Anguela, K.A. High, Entering the Modern Era of Gene Therapy, Annu Rev Med 70 (2019) 273-288.
[2] M.H. Miname, V.Z. Rocha, R.D. Santos, The Role of RNA-Targeted Therapeutics to Reduce ASCVD Risk: What Have We Learned Recently?, Curr Atheroscler Rep 23(8) (2021).
[3] J. Soutschek, A. Akinc, B. Bramlage, K. Charisse, R. Constien, M. Donoghue, S. Elbashir, A. Geick, P. Hadwiger, J. Harborth, M. John, V. Kesavan, G. Lavine, R.K. Pandey, T. Racie, K.G. Rajeev, I. Rohl, I. Toudjarska, G. Wang, S. Wuschko, D. Bumcrot, V. Koteliansky, S. Limmer, M. Manoharan, H.P. Vornlocher, Therapeutic silencing of an endogenous gene by systemic administration of modified siRNAs, Nature 432(7014) (2004) 173-8.
[4] S. Dokka, D. Toledo, X.G. Shi, V. Castranova, Y. Rojanasakul, Oxygen radical-mediated pulmonary toxicity induced by some cationic liposomes, Pharmaceut Res 17(5) (2000) 521-525.
[5] A.S. Abu Lila, H. Kiwada, T. Ishida, The accelerated blood clearance (ABC) phenomenon: clinical challenge and approaches to manage, J Control Release 172(1) (2013) 38-47.
[6] D.D. Taylor, S. Shah, Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes, Methods 87 (2015) 3-10.
(供稿:科研及重点室办公室)