
近日,我室张宏权教授团队在核糖体DNA转录调控乳腺癌转移的新机制和新治疗靶点方面取得新进展。研究揭示出一种受EZH2调控的长链非编码RNA - PHACTR2-AS1 (PAS1) 通过与组蛋白甲基转移酶SUV39H1形成RNA-蛋白复合体,抑制核糖体DNA的转录,增强核糖体DNA的稳定性,从而抑制乳腺癌的生长和转移。该工作于2020年4月20日在肿瘤领域权威杂志Cancer Research上以“The EZH2 - PHACTR2-AS1 - ribosome axis induces genomic instability and promotes growth and metastasis in breast cancer”为题在线发表。
核糖体在真核细胞内负责将信使RNA携带的遗传信息翻译成蛋白质。核糖体的异常激活能够加快蛋白质的合成速率,促进肿瘤细胞的增殖。最新的研究表明核糖体的失调同样促进肿瘤细胞的转移。组蛋白甲基转移酶EZH2与肿瘤的发生发展密切相关,然而,EZH2能否调节核糖体的合成是完全未知的。我们的研究发现,EZH2通过抑制lncRNA PAS1激活核糖体的合成,参与核糖体DNA稳定性的调节。
核糖体DNA (rDNA) 的转录是核糖体合成的起始步骤。核糖体DNA的转录受到多种表观遗传学因素的调控。本项研究发现lncRNA PAS1在核仁内与rDNA结合形成RNA-DNA复合体,然后通过与组蛋白甲基转移酶SUV39H1相互作用将其招募到rDNA的启动区,启动rDNA的H3K9 甲基化修饰。H3K9 的甲基化修饰能够阻止RNA Pol I 与rDNA 的结合,从而抑制核糖体的合成。由EZH2 介导的H3K27 三甲基化修饰沉默lncRNA PAS1后,细胞内rDNA 的转录会被重新激活,核糖体的合成及基因组的不稳定性增加,从而促进了肿瘤的生长和转移。
为了揭示PAS1在乳腺癌治疗中的潜在作用,我们合成了长效的PAS1-30nt-RNA(与SUV39H1直接互作的30 个核苷酸)。在原位已经成瘤(原位注射乳腺肿瘤细胞2周后给药)和肺转移早期(尾静脉注射肿瘤细胞后随即给药)的NOD/SCID小鼠模型中进行了PAS1-30nt-RNA的实验性治疗。结果显示PAS1-30nt-RNA 能够有效抑制小鼠体内原位乳腺癌的生长和肺转移。
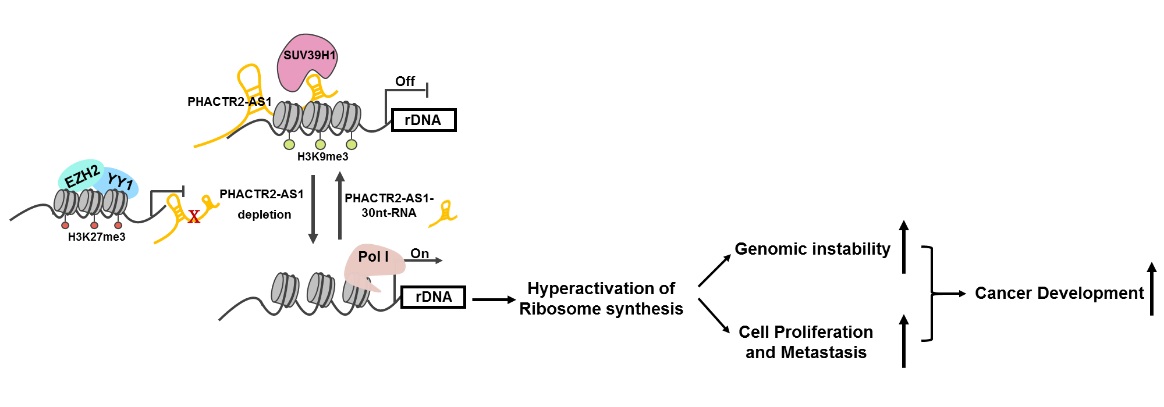
工作模型显示EZH2 - PAS1 - ribosome 调控轴在乳腺肿瘤生长和转移中的作用及机制,并为乳腺肿瘤的治疗提供了新的潜在靶点。
北京大学基础医学院在读博士研究生褚文慧为本文的第一作者,导师张宏权教授和副导师于宇副教授为共同通讯作者。该研究得到了国家自然科学基金重点和面上项目、科技部重大基础研究项目、北京市自然科学基金重点项目及北京大学重点基础研究专项的支持。
论文链接:https://cancerres.aacrjournals.org/content/early/2020/04/18/0008-5472.CAN-19-3326
(基础医学院)