2024年10月,我室黄卓研究团队和北京大学第一医院姜玉武研究团队、英国伦敦大学学院Mala Shah研究团队共同在药理学高影响力期刊British Journal of Pharmacology杂志在线发表题为“Carvedilol inhibits neuronal hyperexcitability caused by epilepsy-associated KCNT1 mutations” 的研究论文,该研究发现常用于治疗高血压的药物卡维地洛,能够有效抑制由钾离子通道KCNT1基因突变引起的神经元过度兴奋,并进一步抑制小鼠癫痫发作,为治疗由KCNT1基因突变引起的癫痫提供了新的治疗途径。

图1 发表论文页截图
KCNT1基因编码的钠激活钾通道(Slack通道),在调节大脑神经元的放电模式中扮演着关键角色[1]。当该基因发生突变时,可能会导致神经元的过度兴奋或异常放电,从而引发多种类型癫痫,主要包括婴儿癫痫伴游走性局灶性发作(epilepsy of infancy with migrating partial seizures, EIMFS)、常染色体显性遗传夜发性额叶癫痫(autosomal dominant nocturnal frontal lobe epilepsy,ADNFLE)、Ohtahara综合征和West综合征等。这些癫痫通常在婴儿期开始发作,而传统抗癫痫药物在这些患者中的疗效有限,往往难以控制病情,导致发育迟缓和严重的癫痫性脑病[2, 3]。因此,开发安全有效的针对KCNT1突变的癫痫药物及新的治疗策略,对于改善患者的生活质量、提高治疗效果具有重要的临床意义和社会价值。
在这项研究中,研究人员在一位患有“婴儿癫痫伴游走性局灶性发作”(EIMFS)的中国女孩身上发现了KCNT1 M267T 突变。研究团队通过在非洲爪蟾卵母细胞和哺乳动物细胞中表达野生型或突变型KCNT1通道,使用膜片钳电生理技术,首次发现KCNT1 M267T突变可以增大通道电流和单通道开放频率,引起功能增强型(gain-of-function)通道特性。
研究团队进一步发现该患儿使用过的临床抗癫痫药物和此前报道对KCNT1突变相关癫痫有治疗作用的奎尼丁(quinidine)[4, 5]都不能明显抑制KCNT1 M267T的电流。为了找到可以明显抑制KCNT1 M267T突变电流的临床药物,研究团队通过电生理技术,筛选了16种FDA批准的可以抑制钾离子通道功能的药物[6-8],发现卡维地洛显著抑制了由KCNT1 M267T突变引起的增强型通道功能,并且这种抑制作用是通过降低单个通道的开放概率实现的。
此外,研究还利用小鼠模型评估了卡维地洛的抗癫痫效果。研究人员通过在小鼠海马CA1锥体神经元中表达野生型和突变型KCNT1 M267T通道,发现M267T突变明显增加了神经元的兴奋性,卡维地洛给药则显著降低了这些突变神经元的兴奋性,并在小鼠癫痫模型中显示出抗癫痫效果。
该研究表明,卡维地洛有潜力成为治疗KCNT1突变相关癫痫的新候选药物,拓宽了降压药物卡维地洛的使用范围,并且为开发更有效、针对性强的癫痫治疗策略提供了重要线索。
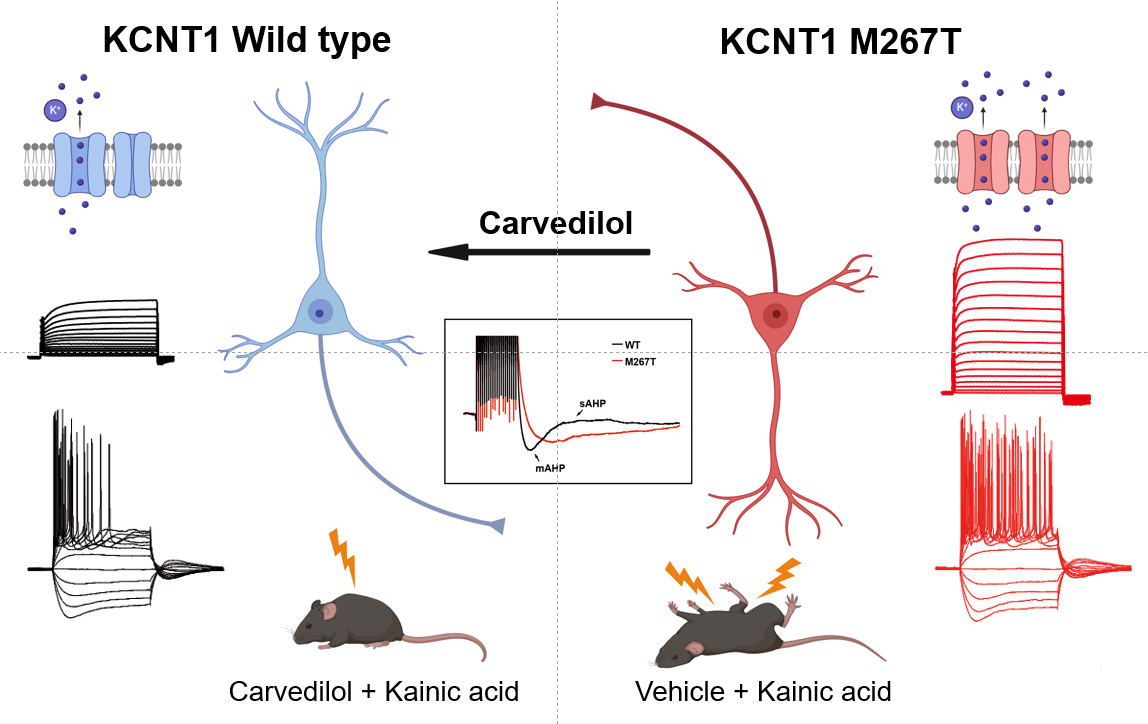
图2 graphical abstract
论文共同第一作者为北京大学药学院博士后底畅(现为北京大学基础医学院主管技师)、北京大学药学院2014级长学制学生吴童、北京大学第一医院助理研究员高凯、北京大学药学院2020级博士生李娜。英国伦敦大学学院药学院Mala Shah教授、北京大学第一医院儿科主任姜玉武教授、北京大学药学院黄卓教授为论文通讯作者。北京大学药学院天然药物及仿生药物全国重点实验室为第一单位,该项研究得到科技部“脑科学与类脑研究”重大项目、国家自然科学基金、国家重点研发计划、北京市自然科学基金等项目的支持。
论文链接:https://bpspubs.onlinelibrary.wiley.com/doi/10.1111/bph.17360
【黄卓课题组简介】

黄卓,北京大学药学院教授、博士生导师,副院长,北京大学天然药物及仿生药物全国重点实验室PI,北京大学麦戈文脑研究院PI,“万人计划”青年拔尖人才,教育部新世纪人才;专注于脑重大疾病的药物靶标发现和药物研发工作。以通讯作者或第一作者在Nature Neuroscience, Nature Comminications, Science Advances, Biological Psychiatry, Cell Discovery等发表SCI论文50多篇。担任4本SCI期刊编委,参编并出版专著6部。目前担任中国药理学会理事,北京药理学会理事,北京药学会理事。
更多实验室工作详见: https://sklnbd.bjmu.edu.cn/kytd/fe4e99acef2a44edbce32418767dfdf0.htm
黄卓课题组欢迎具有神经科学、药理学、心理学、生物医学背景的同学申请研究生。课题组亦诚聘不同学科背景的博士后,待遇从优,欢迎有意向的青年学者发送简历至:huangz@hsc.pku.edu.cn。
【参考文献】
[1] Shore, A. N., Colombo, S., Tobin, W. F., Petri, S., Cullen, E. R., Dominguez, S., Bostick, C. D., Beaumont, M. A., Williams, D., Khodagholy, D., Yang, M., & Weston, M. C. (2020). Reduced GABAergic neuron excitability, altered synaptic connectivity, and seizures in a KCNT1 gain-of-function mouse model of childhood epilepsy. Cell Reports, 33(4), 108303.
[2] Barcia, G., Fleming, M. R., Deligniere, A., Gazula, V.-R., Brown, M. R., Langouet, M., Chen, H., Kronengold, J., Abhyankar, A., Cilio, R., Nitschke, P., & Nabbout, R. (2012). De novo gain-of-function KCNT1 channel mutations cause malignant migrating partial seizures of infancy. Nature Genetics, 44(11), 1255–1259.
[3] Heron, S. E., Smith, K. R., Bahlo, M., Nobili, L., Kahana, E., Licchetta, L., Oliver, K. L., Mazarib, A., Afawi, Z., Korczyn, A., Plazzi, G., & Dibbens, L. M. (2012). Missense mutations in the sodium-gated potassium channel gene KCNT1 cause severe autosomal dominant nocturnal frontal lobe epilepsy. Nature Genetics, 44(11), 1188–1190.
[4] Milligan, C. J., Li, M., Gazina, E. V., Heron, S. E., Nair, U., Trager, C., Reid, C. A., Venkat, A., Younkin, D. P., Dlugos, D. J., Petrovski, S., & Petrou, S. (2014). KCNT1 gain of function in 2 epilepsy phenotypes is reversed by quinidine. Annals of Neurology, 75(4), 581–590.
[5] Numis, A. L., Nair, U., Datta, A. N., Sands, T. T., Oldham, M. S., Patel, A., Li, M., Gazina, E., Petrou, S., & Cilio, M. R. (2018). Lack of response to quinidine in KCNT1-related neonatal epilepsy. Epilepsia, 59(10), 1889–1898.
[6] Wulff, H., Castle, N. A., & Pardo, L. A. (2009). Voltage-gated potassium channels as therapeutic targets. Nature Reviews. Drug Discovery, 8(12), 982–1001.
[7] Cheng, N., Ren, S., Yang, J.-F., Liu, X.-M., & Li, X.-T. (2019). Carvedilol blockage of delayed rectifier Kv2.1 channels and its molecular basis. European Journal of Pharmacology, 855, 50–55.