CRISPR/Cas9系统可以通过精准编辑靶基因来实现对肿瘤、遗传性疾病和感染性疾病等多种疾病的治疗。然而,由于缺乏合适的递送系统,限制了CRISPR/Cas9技术在临床上的应用。目前,CRISPR/Cas9系统的递送方式主要包括:物理方法、病毒载体和非病毒载体。其中物理方法难以在体内使用,病毒载体则存在着潜在的安全性和有效性问题。因此目前许多研究聚焦在非病毒载体上。如何安全有效地将CRISPR/Cas9系统递送至生物体内并发挥其基因编辑功能,仍面临着许多机遇和挑战。
北京大学天然药物及仿生药物国家重点实验室、基础医学院病原生物学系鲁凤民、王杰科研团队探索了CRISPR/Cas9系统是否可以通过外泌体传递其基因编辑功能,并对其机制进行了初步探索。外泌体作为一种重要的细胞与细胞间物质和信息传递的工具,在多种生理和病理过程中都发挥着非常重要的作用,被广泛应用于诊断和治疗领域。基于前期研究,该研究团队首先通过一系列实验证实CRISPR/Cas9系统中的gRNA和Cas9蛋白功能组分可经细胞产生的外泌体释放至细胞外,并可以在细胞间传递CRISPR/Cas9系统的基因编辑活性。此外,为了探索外泌体在传递CRISPR/Cas9系统的潜在应用价值,研究团队发现通过生物工程细胞Vero和CHO细胞可制备携带功能性gRNA和Cas9蛋白的外泌体,并可通过此外泌体将gRNA和Cas9蛋白传递至靶细胞,实现CRISPR/Cas9系统基因编辑功能的传递。本研究首次发现细胞产生的外泌体能将功能性的gRNA和Cas9蛋白传递至周围靶细胞发挥基因编辑功能。由于外泌体具有较高的生物安全性,加之gRNA和Cas9蛋白在细胞内会很快降解,所以直接传递gRNA和Cas9蛋白在理论上可以大大降低二者持续表达所带来的脱靶效应风险,并且不存在传递CRISPR/Cas9表达质粒带来的整合风险。因此,外泌体有可能成为CRISPR/Cas9系统的一种安全、有效的递送方式。除此之外,该研究提示我们,在利用CRISPR/Cas9系统进行基因治疗的过程中,也需要考虑携带有gRNA和Cas9蛋白的外泌体对周围及远端组织细胞的潜在影响。
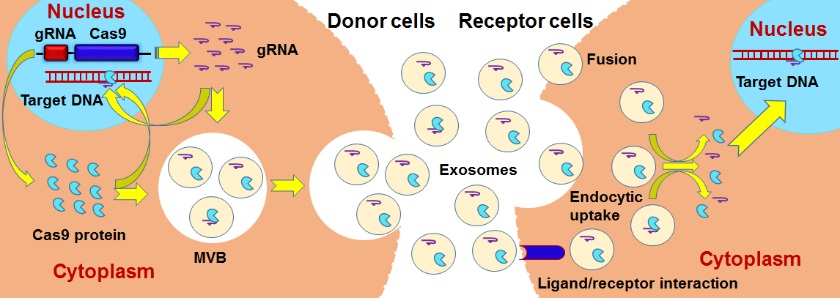
CRISPR/Cas9系统通过外泌体传递其基因编辑功能模式图:CRISPR/Cas9系统中的gRNA和Cas9蛋白功能组分可经细胞产生的外泌体释放至细胞外,并可以在细胞间传递CRISPR/Cas9系统的基因编辑活性。
该研究成果于2019年7月4日在国际学术期刊《Small》发表。该工作加深了对CRISPR/Cas9系统发挥高效基因编辑功能的分子生物学机制的理解,为进一步开发安全有效的CRISPR/Cas9的递送系统提供了新思路。
该工作得到了国家“艾滋病和病毒性肝炎等重大传染病防治”科技重大专项、北京市自然科学基金等项目资助。
原文链接:https://onlinelibrary.wiley.com/doi/pdf/10.1002/smll.201902686
【作者教授简介】

鲁凤民,北京大学医学部基础医学院病原生物学系暨感染病中心教授、学系主任,天然药物及仿生药物国家重点实验室PI。本科毕业于河南医科大学,于哈尔滨医科大学获医学遗传学硕士和博士学位,北京大学公共卫生学院博士后。曾在瑞典、美国留学。长期从事病毒性肝炎、肿瘤等相关研究。主要学术成就有:实验证实了HBV RNA病毒样颗粒的存在,补充完善了HBV的生命周期;并提出了以血清HBV RNA检测预测核苷(酸)类药物停药安全性的建议;明确了血清GP73作为不同病因肝硬化的无创诊断指标,等。在New England Journal of Medicine、Journal of Hepatology、Cancer Research等杂志发表120余篇SCI论文(著),他引超过3100次。 曾作为参加人两次获得国家科技进步二等奖。
王杰,2015年博士毕业后留校工作。现任北京大学医学部病原生物学系助理教授(tenure track)、副研究员。
(编辑:宋书香)