2025年2月24日,我室分子互作平台王静副主任技师与合作者在国际学术期刊Journal of the American Chemical Society发表了题为“Identification of Cell Receptors Responsible for Recognition and Binding of Lipid Nanoparticles”的研究工作。

LNP作为核酸疫苗的关键递送载体,在进入人体后会迅速吸附血液中的蛋白形成“蛋白冠”,其组成直接决定LNP的体内命运,如靶向性、免疫反应和清除效率等。研究团队前期基于生物膜干涉(BLI)技术建立了纳米颗粒表面多层蛋白冠的原位、动态分析方法(Nat. Commun., 2022, 13, 5389)。在此基础上,团队进一步利用分子互作技术(SPR、BLI)开发了基于生物传感的“Fishing”平台,实现了对LNP表面结合蛋白冠动态形成过程的精准捕获和识别(如下图)。结果显示,相较于传统离心方法,该方法更能真实地反映LNP表面蛋白冠组成:免疫球蛋白(尤其是抗PEG抗体)和补体成分在“硬蛋白冠”中显著富集,而白蛋白则主要分布于“软蛋白冠”。
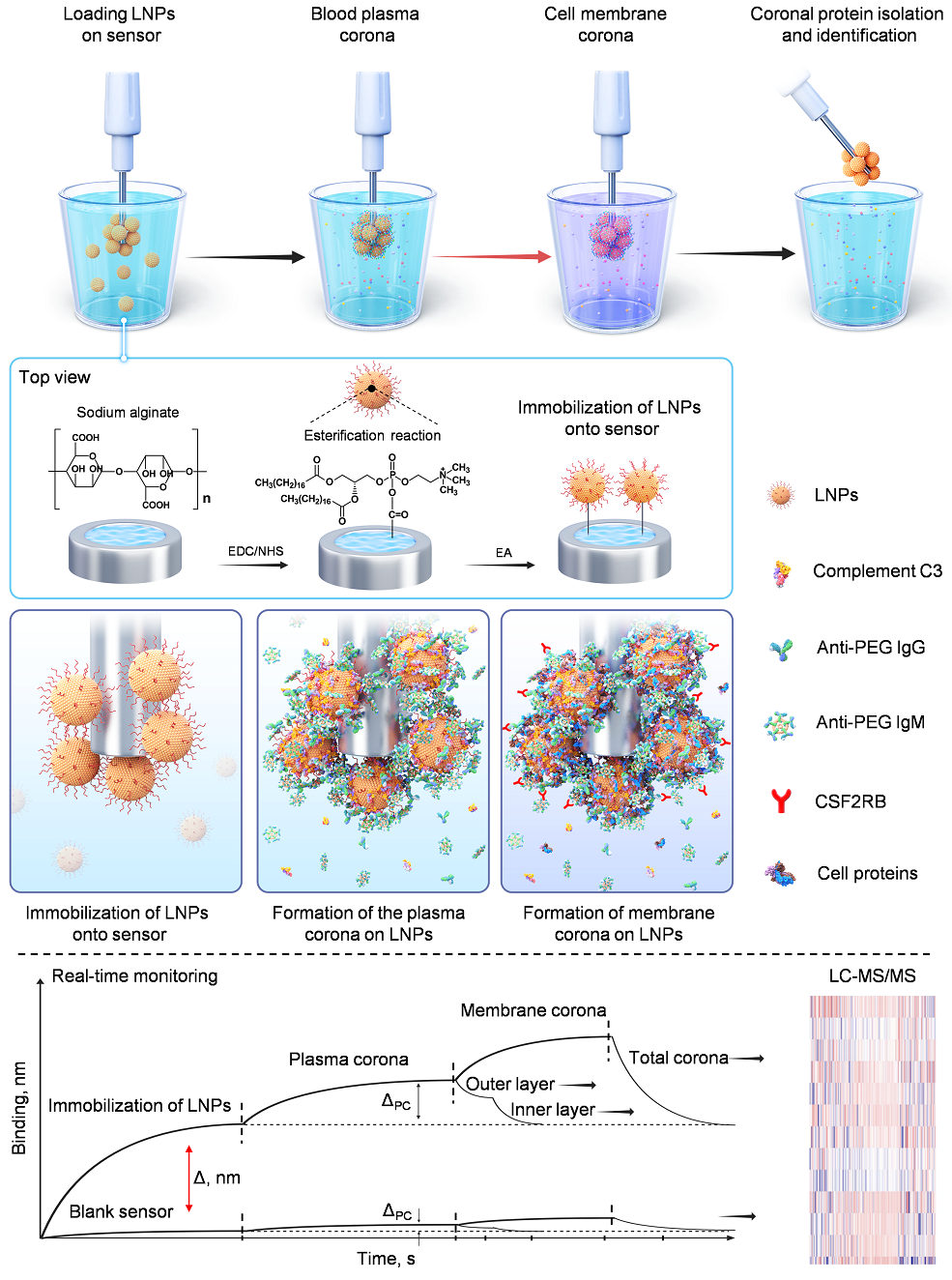
开发“Fishing”技术用于识别LNP表面蛋白冠及细胞膜受体
研究表明,新冠疫苗的广泛接种导致人体内抗PEG抗体水平显著上升,这一生理变化深刻影响了PEG化纳米药物在体内的清除机制。为了深入理解PEG化纳米药物的清除机制,研究团队利用“Fishing”平台,解析了LNP表面蛋白冠从初始血浆蛋白吸附到特异性富集关键蛋白,再到与髓系细胞膜受体相互作用后发生的动态重塑过程。该研究首次系统揭示了抗PEG抗体及补体成分在LNP细胞识别和免疫清除中的关键作用,并鉴定出集落刺激因子2受体β(CSF2RB)为LNP识别髓系细胞的关键受体。这一发现阐明了为何PEG化纳米药物在不同个体中的循环时间存在显著差异,以及为何PEG化药物或疫苗在重复给药过程中往往会导致更快的清除。
该研究揭示了LNP在人体血液中形成的动态蛋白冠组成及其与免疫细胞受体相互作用的关键机制,不仅为纳米药物的合理设计提供了重要的科学依据,也为开发更稳定、更具靶向性的mRNA疫苗、基因治疗载体及精准纳米医学技术提供了新的思路。
中国科学院高能物理研究所博士后Baimanov Didar、北京大学天然药物及仿生药物全国重点实验室副主任技师/北京大学宁波海洋药物研究院副研究员王静博士为该论文共同第一作者,国家纳米科学中心陈春英院士、中科院高能物理研究所王黎明研究员为该论文共同通讯作者。天然药物及仿生药物全国重点实验室核磁平台刘芬老师、质谱平台师晓萌和张晓辉老师在研究中给予了大力支持。上述工作得到了国家重点研发计划、国家自然科学基金、北京市自然科学基金、北京同步辐射装置建制化科研平台、新基石科学基金、宁波市重大科技项目的资助。
论文链接:https://pubs.acs.org/doi/10.1021/jacs.4c16987
【王静简介】

王静,博士,北京大学药学院天然药物及仿生药物全国重点实验室副主任技师,北京大学宁波海洋药物研究院特聘副研究员,硕士研究生导师。2016年7月于国家纳米科学中心获得博士学位,导师为陈春英院士。2016年8月起,在北京大学天然药物及仿生药物全国重点实验室大型仪器平台工作,负责生物分子相互作用平台的建设管理、测试服务和新方法新体系开发。主要研究方向为分子互作、纳米递送和拉曼光谱技术在生物医学和药学研究中的应用。近年来以第一/共一/通讯作者在Nat. Commum., Adv. Mater., J. Am. Chem. Soc., Theranostics, Anal. Chem.等国际著名期刊上发表科研论文17篇。主持国家自然科学基金青年项目、国家自然科学基金面上项目、宁波市重大专项等。申请/授权发明专利6项。