2024年11月6日,我室谢海燕团队与合作者在Journal of the American Chemical Society杂志刊登了在肿瘤免疫精准可视化方面的最新研究成果“AND-gate Logic Förster Resonance Energy Transfer/ Magnetic Resonance Tuning Nanoprobe for Programmable Anti-tumor Immunity Imaging”(用于程序性抗肿瘤免疫成像的“AND”逻辑门Förster共振能量转移/磁共振调谐纳米探针) 。

免疫治疗可有效激活机体的免疫反应,缓解和抑制肿瘤生长,延长患者的生存期。然而由于个体以及肿瘤的异质性,目前仅有少数患者能够从免疫治疗中获益。因此,准确评估抗肿瘤免疫应答对于提高治疗效果,改进治疗策略,改善预后都非常重要。基因组测序、液体活检和病理分析等多种方法都已经被用于评估免疫响应,但都有明显不足。分子成像尤其是活体成像能够实时、无创地监测免疫效果,但已有方法的准确性不理想,其重要原因在于免疫响应是一个非常复杂和动态变化的过程,依赖单一免疫生物标志物的评估方法容易导致“假性进展”。一种可能的解决方案是同时监测免疫过程中的多种免疫标志物,特别是时空动态、程序性变化的免疫标志物,但到目前为止很少有报道。
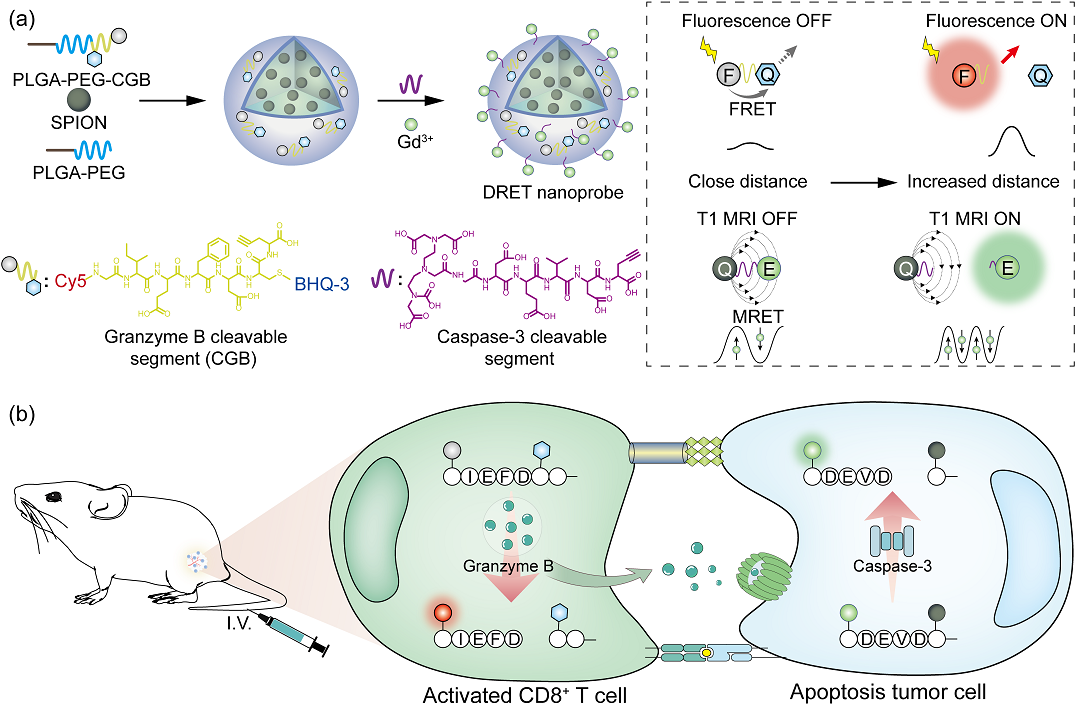
针对以上抗肿瘤免疫精准可视化的瓶颈问题,文章提出了一种“AND”逻辑门双共振能量转移纳米探针(FRET/MRET,DRET),用于动态监测免疫响应中CD8+T细胞的活化和肿瘤细胞的凋亡。体外研究表明,DRET纳米探针中Förster共振能量转移(FRET)导致的荧光猝灭仅在遇到活化的CD8+T细胞所释放的颗粒酶B(GrB)时才会恢复,而磁共振调谐(MRET)导致的磁共振T1信号减弱仅在凋亡的肿瘤细胞释放天冬氨酸蛋白水解酶-3(Cas-3)时才得到增强。以此在多种肿瘤细胞中实现了免疫调节药物的精准筛选。体内研究表明,DRET纳米探针可在肿瘤体积明显变化之前通过荧光成像和磁共振成像信号的双重变化准确预测免疫治疗效果,检测的灵敏度与流式细胞术/组织病理学染色得到的结果相当,同时具有非侵入性和动态性的优势。特别的,该探针还可以通过荧光和磁共振成像信号的不一致性识别程序性死亡受体-1抗体(aPD-1)治疗中的免疫耐药,区分“持续响应”和“获得性耐药”小鼠,提供了一种通过活体分子成像精准评估程序性抗肿瘤免疫响应的新方法。
北京大学药学院谢海燕教授、南开大学化学院庞代文教授为论文的通讯作者。北京大学医学部医药卫生分析中心的袁兰老师和徐陆正老师为该研究提供了重要帮助。北京大学药学院天然药物及仿生药物全国重点实验室为第一单位。该研究获得国家自然科学杰出青年基金、国家自然科学重大项目等项目的支持。
论文链接:https://pubs.acs.org/doi/10.1021/jacs.4c11072
【谢海燕教授简介】

谢海燕,教授,博士生导师。北京大学博雅特聘教授/博导,国家自然科学杰出青年基金、优秀青年科学基金获得者,教育部“新世纪优秀人才支持计划”和北京市“优秀人才资助计划”入选者,英国皇家化学会会士,中国生物材料学会理事,中国生物材料学会纳米生物材料分会常委,Smart Molecules 编委,New Journal of Chemistry 顾问委员。先后主持国家自然科学重大项目课题、国家重大科学研究计划(973)项目课题等科研项目15项。在Nat. Biomed. Eng., Nat. Common., Acc. Chem. Res., Angew. Chem. Int. Edit.等刊物发表SCI收录论文百余篇;申请国家发明专利12项,并已授权转化2项,其中1项已投入大批量生产;获省部级自然科学一等奖1项、技术发明特等奖1项。