近年来,以蛋白质等生物大分子为目标的化学合成成为化学生物学领域的一个研究热点,而自然化学连接(Native Chemical Ligation)则是制备蛋白质的化学方法中最为有效的多肽连接方法之一。在温和的条件下,自然化学连接能够将一段多肽硫酯和一段N-末端含巯基取代氨基酸的多肽连接起来,生成一条分子量更大的多肽。在合成由天然氨基酸组成的多肽的过程中,研究者们发现C-末端为脯氨酸的多肽硫酯具有制备方便、不易消旋的优势,但其在自然化学连接反应中活性极低,如何将其应用到蛋白合成中是一个长期未能得到很好解决的难题。
我室董甦伟课题组从影响脯氨酸硫酯反应活性的因素出发,设计合成含有 [2.2.1]双环结构的多肽内硫酯中间体,通过分子构型的变化减弱轨道相互作用和位阻影响,并利用环张力对脯氨酸硫酯进行的活化。这一“内活化”的策略成功实现了一系列含有thioPro-thioXaa片段的多肽连接,再通过温和的无金属脱硫条件即得到含有Pro-Xaa的天然多肽。该方法连接效率高,化学选择性好,底物适用性强,对天然氨基酸侧链以及含糖基取代的多肽都具有良好的兼容性。此外,与前人发展的方法相比,该方法通过在脯氨酸4位引入的巯基实现活化,无需额外添加活化剂,可以通过“连接-脱硫”的一锅法简化操作步骤,从而显著提高合成效率。通过合成人肾母细胞瘤蛋白1(WT1)的一个富脯氨酸区域,该方法也被证明可应用于分子量较大的多肽及糖蛋白的合成中,尤其是含有富脯氨酸区域的蛋白质的化学合成中。
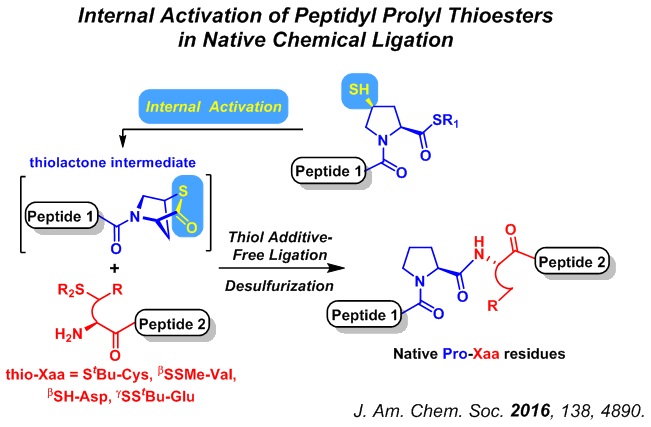
这一研究成果发表于《美国化学会志》(J. Am. Chem. Soc. 2016, 138, 4890-4899)。药学院10级长学制学生桂悦是这项工作的第一作者。该项目得到了国家千人计划和国家自然科学基金的资助。
重点室办公室 供稿