近日,学术期刊《Journal of the American Chemical Society》在线发表了我室董甦伟团队题为 “O-Glycosylation Induces Amyloid-β to Form New Fibril Polymorphs Vulnerable for Degradation”(O-糖基化诱导β淀粉样多肽形成新的易降解纤维聚集体)的研究成果。
β淀粉样多肽(Aβ)的错误折叠以及在大脑中的聚集被认为与阿尔兹海默症(AD)的发生发展密切相关。越来越多的实验证据显示在AD等神经退行性疾病中,脑内多种病理相关蛋白的糖基化位点、数量和水平都出现了显著改变,暗示了糖基化修饰在AD发生和发展中的重要意义。2011年,Nilsson团队在AD病人脑脊液中Aβ片段上鉴定到此前未在哺乳动物中发现的酪氨酸O-糖基化修饰,然而受限于天然来源翻译后修饰蛋白丰度低、微观不均一等困难,这一糖基化修饰的生物学功能及在疾病中的作用尚未能得以阐释。
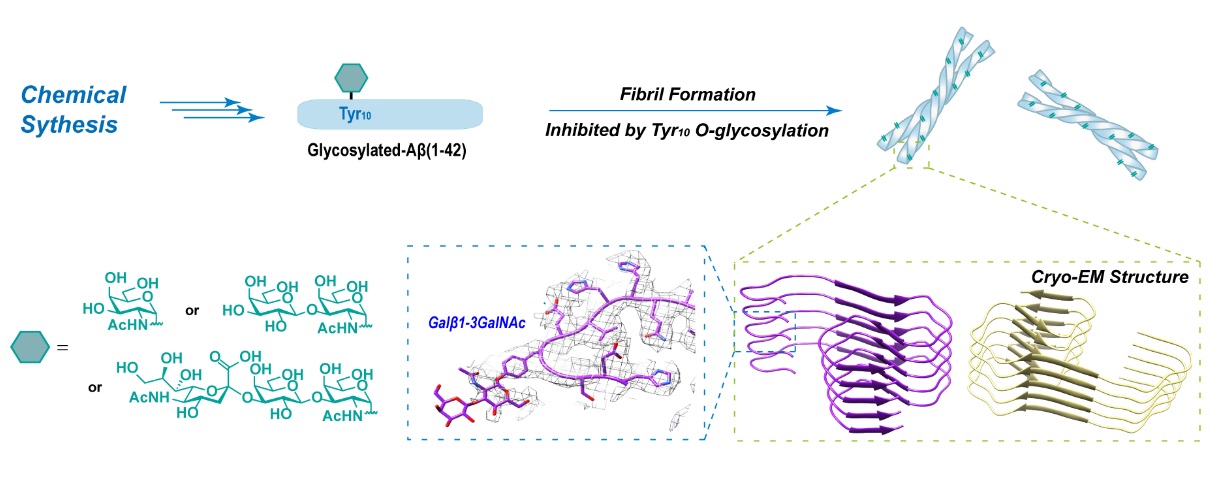
董甦伟团队利用化学合成策略构建了一系列含不同O-糖基化修饰(包括粘蛋白mucin糖型中代表性的α-GalNAc、Galβ1-3GalNAc和Neuα2,3Galβ1-3GalNAc)的均一结构β淀粉样多肽,并基于其系统研究了糖链对Aβ病理性聚集的调控作用及其构效关系。
基于化学合成策略探究糖基化修饰对Aβ42生物物理性质的调控
作者运用光谱学及电镜等手段对三种Aβ糖肽、以及不含糖链原始Aβ多肽的二级结构、聚集性质、纤维形态等进行表征,发现糖基化修饰能够显著抑制Aβ的聚集,并且随着糖链结构的增大,这一抑制作用也随之增强,这体现了糖链结构复杂程度(包括尺寸效应等)在增强亲水性以外对Aβ聚集的另一个调控维度。对Aβ聚集/解聚的动力学进行进一步研究发现糖基修饰可以降低已形成纤维的结构稳定性。随后的胰岛素降解酶(IDE)降解实验表明含有糖基修饰的Aβ纤维由于其结构不稳定性,表现出了更低的酶解稳定性,而降解过程产生的酶切产物也与体内所鉴定到的糖肽片段相吻合。
为了进一步理解糖基化修饰降低Aβ病理性纤维稳定性的分子机制,董甦伟团队与中科院上海有机所生物与化学交叉中心刘聪团队合作,利用冷冻电镜技术解析了带有Galβ1-3GalNAc糖型修饰的Aβ纤维结构,发现糖基化诱导Aβ组装形成了一种新颖的淀粉样纤维结构。相比于未修饰的Aβ纤维,该纤维结构具有更小的原纤维组装接触面,介导Aβ原纤维组装形成成熟纤维的分子间作用力更弱。
该工作首次发现糖基修饰在动态调控Aβ病理性聚集方面的重要功能,为后续不同糖基修饰调控神经退行性疾病病理蛋白聚集的生物活性及病理毒性研究提供了有利的研究工具及新的研究思路。

部分研究团队成员合影,左起:黄璐,魏琦佳,董甦伟,刘当亮,张淇凯,汪晓娅
该项研究获得国家自然科学基金重大研究计划、优秀青年基金,科技部重点研发计划、北京市自然科学基金杰出青年基金、中国科学院稳定支持基础研究领域青年团队计划等项目资助。北京大学药学院2016级长学制刘当亮、魏琦佳及中科院上海有机所2020级硕士夏文程为该论文的共同第一作者,董甦伟研究员和刘聪研究员为共同通讯作者。
论文链接:https://pubs.acs.org/doi/full/10.1021/jacs.1c08607
【董甦伟研究员简介】

董甦伟 博士,北京大学研究员、博士生导师,北京大学药学院化学生物学系主任、天然药物及仿生药物国家重点实验室PI。入选国家海外高层次青年人才、北京市优秀青年人才。长期致力于蛋白质化学合成和糖基化功能研究、多肽及蛋白药物的合成及改造,以第一作者或通讯作者身份在Science、J. Am. Chem. Soc.、Adv. Sci.、Angew. Chem. Int. Ed.、Chem. Sci.等学术刊物发表多篇学术论文;作为负责人获国家自然科学基金优秀青年基金项目、北京市自然科学基金杰出青年基金项目等资助。先后获得 “中国药学会-施维雅”青年药物化学奖、中国化学会糖化学青年学者奖等奖励。