近日,我室生物影像平台李文哲博士与合作者在国际学术期刊Angewandte Chemie International Edition上发表了题为“PD-L1 Aptamer-Functionalized Metal–Organic Framework Nanoparticles for Robust Photo-Immunotherapy against Cancer with Enhanced Safety”的研究工作,并被选为封面论文。

癌症的免疫检查点阻断疗法(immune checkpoint blockade, ICB)在临床上取得系列进展,然而,免疫检查点抑制剂如抗PD-L1抗体(α-PD-L1)的常规给药方式,往往导致免疫应答不理想,特别是一些“冷肿瘤”淋巴细胞浸润不足,难以发挥药物疗效。同时,常规ICB疗法常常伴随严重的免疫相关不良反应(irAEs)。
针对上述挑战,研究团队开发了一种基于PD-L1核酸适体(aptPD-L1)的纳米球形核酸(SNA)M@O-A,实现了高效且安全低毒的肿瘤光免疫治疗。该纳米体系由一线化疗药奥沙利铂(OXA)包封的卟啉Zr6-MOF(PCN-224)纳米粒核心和aptPD-L1的致密外壳组成。其在肿瘤部位首先利用aptPD-L1阻断肿瘤细胞表面PD-L1蛋白发挥其ICB疗效,随后在近红外光照射下,纳米系统发挥光动力疗法(PDT)产生活性氧ROS,并释放OXA,二者诱导细胞发生免疫原性死亡(ICD),协同激活免疫系统,显示出强大的细胞杀伤能力。
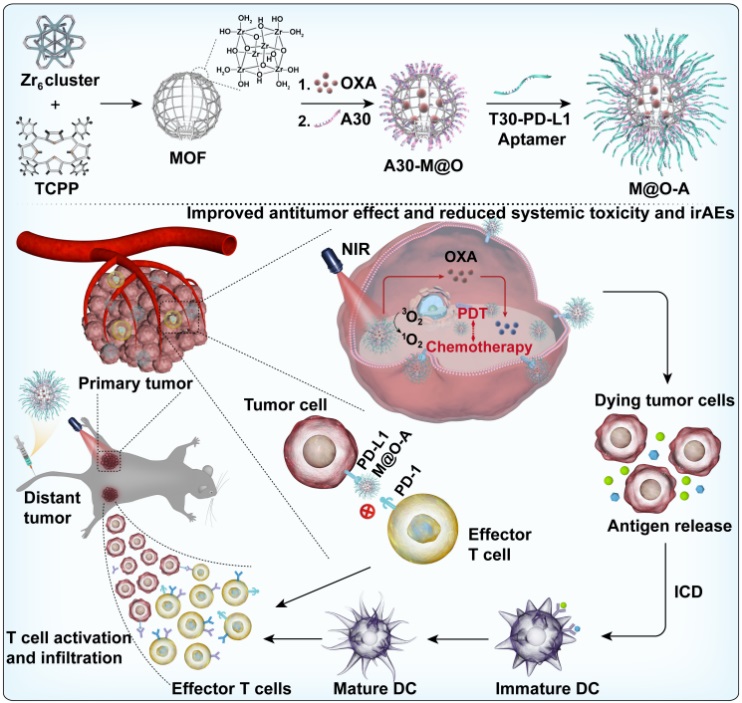
M@O-A 纳米药物的设计、合成及利用其实现肿瘤化疗、光动力治疗及免疫治疗协同联用的示意图
研究团队借助多种光学成像技术,证明该纳米粒具有良好的肿瘤靶向性,可在肿瘤部位长时间富集,并保护aptPD-L1不被降解,大大提高ICB疗法的响应度及治疗效果。该方法通过化疗、光动力治疗及免疫治疗的协同联用,杀伤肿瘤的同时激活肿瘤微环境中的抗肿瘤免疫,最终实现了对原位瘤的根治及对远端瘤生长的显著抑制。值得一提的是,在模拟临床irAEs的C57BL/6 Foxp3-GFP-DTR转基因小鼠模型中,M@O-A几乎没有显示出任何免疫相关毒性,证明了该方法的安全性。该研究开发的癌症光免疫协同疗法有望为提高临床肿瘤免疫治疗疗效,并同时解决治疗过程中出现的免疫相关不良反应等副作用提供新策略。
北京科技大学张婧芳博士后、北京大学药学院天然药物及仿生药物国家重点实验室李文哲博士、中科院分子影像重点实验室齐亚飞博士为该论文共同第一作者,中国科学院分子影像重点实验室田捷教授、杜洋研究员及北京协和医院放射科金征宇主任为通讯作者。该工作得到了国家自然科学基金、北京市自然科学基金等项目资助。

论文和封面链接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202214750
https://onlinelibrary.wiley.com/doi/10.1002/anie.202218931
【李文哲博士简介】

李文哲,2019年于北京大学获得理学博士学位,博士期间与国家纳米科学中心联合培养。2019年8月起在北京大学天然药物及仿生药物国家重点实验室工作,负责生物影像平台的运行管理、技术支撑及新方法新体系开发,并进行相关课题研究。主要利用共聚焦超分辨显微成像技术、双光子显微成像技术及光学/光声/超声小动物成像技术为校内外100余课题组提供技术支持,帮助课题组在Nat. Nanotech., Nat. Biomed. Eng., Nat. Commun., Angew. Chem. Int. Ed., Adv. Sci.等国际一流期刊发表论文20余篇。近年来以第一/共一作者在Angew. Chem. Int. Ed., Adv. Mater., Small Methods., Nanomaterials等国际著名期刊上发表多篇学术论文。主持1项国家自然科学基金青年项目,申请发明专利2项。
(编辑:宋书香)