化学小分子可以将体细胞重编程为多潜能干细胞(CiPS细胞),使其具有向多种细胞类型分化的能力。进一步报道表明,小鼠成纤维细胞重编程为CiPS细胞过程中,会经历一个化学激活的多谱系待发(CaMP, chemically activated multi-lineage priming)状态1,然后转化为胚外内胚层(XEN, extraembryonic endoderm)样细胞2,并最终重编程为多能干细胞(PSC)。然而有意思的是,这一过程中对于CaMP状态、XEN样细胞和CiPS细胞诱导都不可或缺的一种Alk5抑制剂E-616452并不能被其它的Alk5抑制剂替代,其下游作用机制还很不清楚。
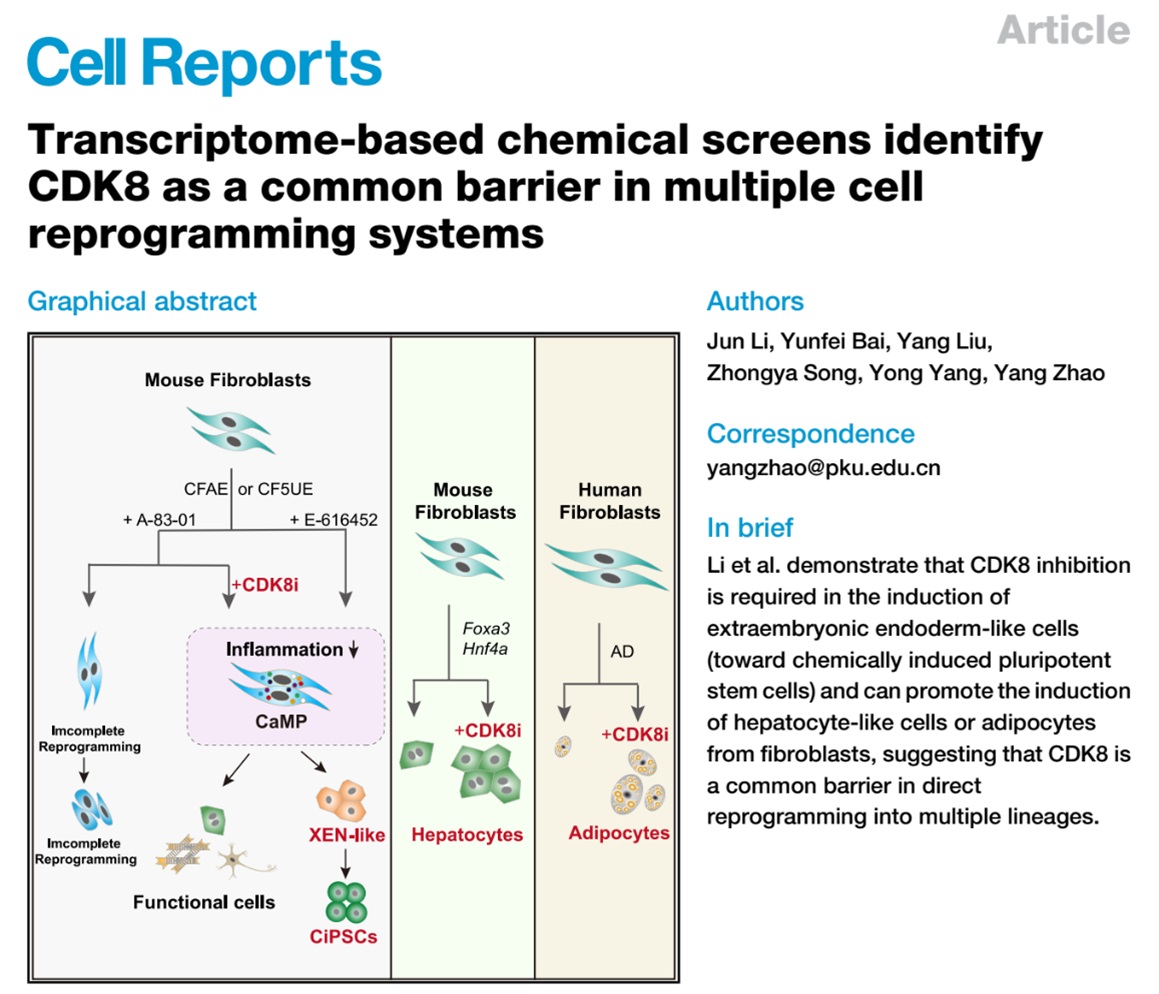
图1 文章的模式图
2023年5月24日,我室赵扬团队在Cell Reports 上发表了题为 Transcriptome-based chemical screens identify CDK8 as a common barrier in multiple cell reprogramming systems 的研究论文。该论文报道了通过一种基于转录谱测序进行高通量筛选的新方法(Drug-seq2)揭示了E-616452除了抑制Alk5之外、还通过抑制CDK8来发挥启动细胞命运转变的作用。有趣的是,CDK8的抑制尽管没有提升整体的染色质可及性,但使细胞得建立了“可塑性”的CaMP状态1,3。
研究者首先揭示E-616452小分子不能被其已知靶点Alk5的其他小分子(A83-01,SB431542,LY364947等)抑制剂替代来诱导XEN-like克隆的产生(图2),提示E-616452存在除ALK5外的关键靶点,可能是化学重编程得以发生的重要机制之一。
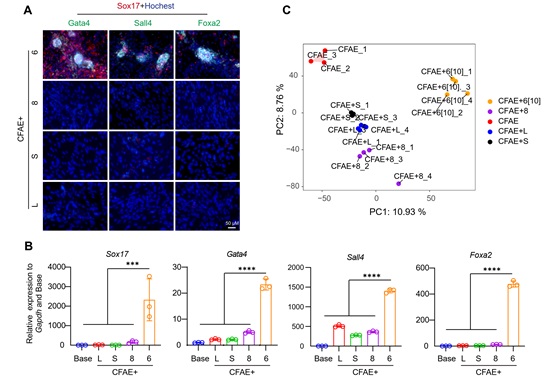
图2 ALK5的小分子抑制剂中只有E-616452能诱导XEN-like克隆
为了探究这个作用机制,研究者建立了基于转录谱测序技术的小分子筛选方法Drug-seq2,通过比较小分子处理后的样品转录谱来反映样品之间细胞命运的相似性。以不含E-616452的培养基为基础培养基,他们从激酶小分子库中成功筛选出在转录组上和E-616452有相似度的候选小分子化合物。在这些候选小分子中,和E-616452相似性最高的小分子是MSC2530818,一个CDK8的抑制剂。激酶抑制实验显示,E-616452和MSC2530818均能显著抑制CDK8的活性(IC50分别为428nM和1.12nM),而Alk5同靶点的小分子抑制剂A83-01则几乎不能抑制CDK8(IC50为4277nM)(图3A),提示E-616452在CiPS细胞诱导中的特殊作用可能是抑制CDK8的活性。进一步,采用CDK8的另一小分子抑制剂BI-1347,或者通过遗传学手段敲低CDK8均有与E-616452类似的诱导重编程的效果——不仅在诱导早期它们能显著激活XEN-like标志基因(Sox17、Sall4、Gata4、Foxa2)的表达(图3B和C),而且能够最终支持CiPS细胞的诱导(图4)。
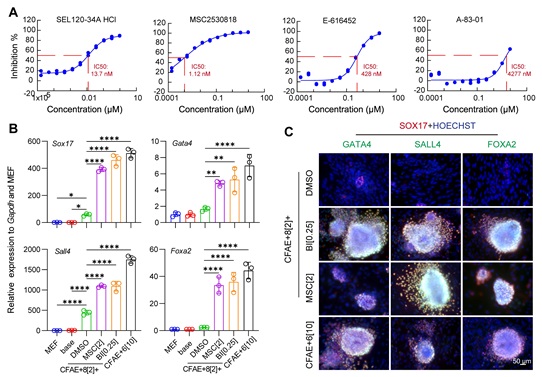
图3 CDK8抑制剂可以替代E-616452诱导XEN-like克隆产生
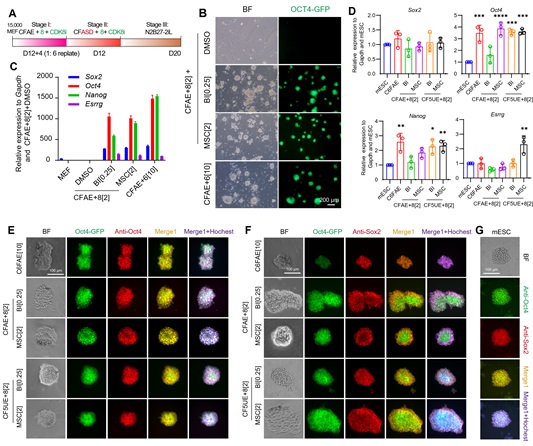
图4 CDK8抑制剂可以全程替代E-616452诱导CiPSC的产生
更有意思的是,尽管CDK8的抑制没有提高染色质可及性的程度,但只有在CDK8抑制的情况下,细胞才能在重编程早期产生“多谱系待发”的CaMP状态,这提示CDK8抑制可能会有助于多种功能细胞命运的诱导。进一步研究也发现抑制CDK8也同样有助于提升成纤维细胞向肝实质细胞或脂肪细胞的重编程效率,是多个重编程系统共同的分子障碍。这一研究成果不仅揭示了化学重编程的关键靶点,为我们理解细胞命运维持、决定和重编程提供了理论基础,也为进一步提高细胞重编程效率并开发更多功能细胞的重编程体系提供了新靶点。该研究工作所建立的基于转录组的高通量筛选技术也为细胞命运调控的研究、以及小分子化合物的靶点研究提供了新型工具。
北京大学未来技术学院、生命科学联合中心赵扬赵扬研究员指导了此项工作,是该成果的通讯作者。北京大学前沿交叉学科研究院生命科学联合中心2017级博士生李军和未来技术学院2017级博士生白云飞为该论文的共同第一作者,南京昕瑞再生医药科技有限公司提供了Drug-seq2技术的具体方案。该工作得到了国家重点研发计划(2019YFA0110000, 2018YFA0800504)、国家自然科学基金、北京大学-清华大学生命科学联合中心和南京昕瑞再生医药科技有限公司项目的资助。
论文链接:https://www.sciencedirect.com/science/article/pii/S2211124723005776
参考文献:
1. Yang, Z. et al. Chemical Pretreatment Activated a Plastic State Amenable to Direct Lineage Reprogramming. Frontiers in cell and developmental biology 10, 865038-865038, doi:10.3389/fcell.2022.865038 (2022).
2. Zhao, Y. et al. A XEN-like State Bridges Somatic Cells to Pluripotency during Chemical Reprogramming. Cell 163, 1678-1691, doi:10.1016/j.cell.2015.11.017 (2015).
3. Bai, Y. et al. Direct chemical induction of hepatocyte-like cells with capacity for liver repopulation. Hepatology , doi:10.1002/hep.32686 (2022).
【赵扬研究员简介

北京大学分子医学研究所研究员,博士生导师,细胞重编程和再生医疗研究室主任,天然药物及仿生药物全国重点实验室PI。主要研究领域:(1)小分子诱导细胞重编程的分子机制研究;(2)心血管系统和代谢系统相关功能细胞(例如心肌细胞、肝脏细胞等)的直接重编程和原位再生;(3)逆转组织器官纤维化及诱导组织器官原位再生的小分子药物开发。