2025年2月21日,我室谢海燕团队与合作者在Science Advances杂志刊登了通过诱导三级淋巴结从头生成提高肿瘤免疫治疗效果的最新研究成果“Intratumoral antigen-presenting cell activation by a nanovesicle for the concurrent tertiary lymphoid structure de novo neogenesis”(纳米囊泡激活瘤内抗原呈递细胞诱发三级淋巴样结构从头生成) 。

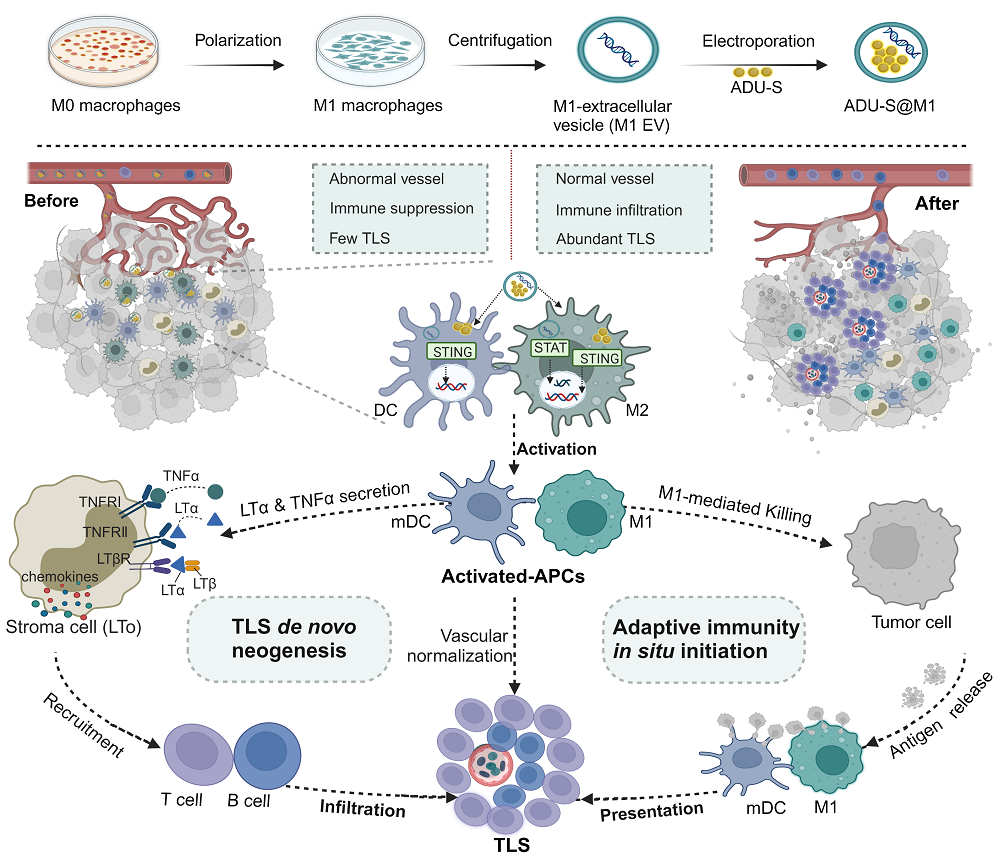
尽管肿瘤免疫治疗取得了巨大成功,但迄今为止只有少数患者受益。重要的原因是机体的免疫响应低,而免疫抑制机制复杂多变。肿瘤微环境(TME)中的三级淋巴结构(TLS)不仅能原位诱导适应性免疫响应,还能显著改善免疫抑制性TME。因此,TLS的数量通常与免疫治疗的效果密切相关。但是,由于瘤内免疫细胞稀少,TLS很难在肿瘤中自然生成。因此,诱导TLS形成是提高抗免疫治疗效果的重要措施。然而,TLS的形成是多因素共同作用的系统演变过程,已有针对某一步骤或因素的策略都难以诱导TLS的高效生成;而且,即使形成了TLS,如果没有原位抗原释放和提呈过程的协同,也难以产生高效适应性免疫应答。因此,迫切需要开发新的策略,高效诱导TLS新生,同时促使适应性免疫响应的发生,以显著提高免疫治疗效果。
作者发现活化的抗原呈递细胞(APCs),包括M1巨噬细胞和成熟的树突状细胞(mDCs),表达大量的LTα和TNFα,可以启动TLS新生。受此启发,他们将STING激动剂ADU-S100 (ADU-S)加载到M1细胞来源的细胞外囊泡(M1 EVs)中,构建仿生纳米系统。所制备的ADU-S@M1达到肿瘤组织中之后,通过激活STAT1和STING通路,促进肿瘤相关巨噬细胞(TAM)从M2型极化为M1型,同时诱导DCs成熟,产生大量活化APCs的同时逆转免疫抑制性TME。活化的APCs一方面产生抗血管生成素,促使血管和淋巴正常化,为淋巴细胞的募集扫清道路;另一方面,作为淋巴组织诱导细胞(LTi),持续分泌LTα和TNFα,诱导肿瘤基质细胞(LTo)产生淋巴趋化因子,募集大量淋巴细胞到肿瘤组织,诱导TLS的从头生成。同时,M1细胞有效杀死肿瘤,导致大量抗原的原位释放,进而被活化的APCs捕获并就近递送到TLS,诱发高效的肿瘤特异性适应性免疫响应,可有效抑制肿瘤的生长,且在免疫抑制性冷肿瘤中也取得了理想的效果。
北京大学药学院谢海燕教授、北京理工大学聂伟东副教授为论文的通讯作者。该研究获得国家自然科学杰出青年基金、国家自然科学重大项目等项目的支持。
论文链接:https://www.science.org/doi/10.1126/sciadv.adr1299
【谢海燕教授简介】

谢海燕,北京大学博雅特聘教授/博导,国家自然科学杰出青年基金、优秀青年科学基金获得者,教育部“新世纪优秀人才支持计划”和北京市“优秀人才资助计划”入选者,英国皇家化学会会士,中国生物材料学会理事,中国生物材料学会纳米生物材料分会和中国抗癌协会纳米肿瘤学专业委员会常委,Smart Molecules编委,New Journal of Chemistry顾问委员。先后主持国家自然科学重大项目课题、国家重大科学研究计划(973)项目课题等科研项目16项。在Nat. Biomed. Eng., Nat. Common., Acc. Chem. Res., Angew. Chem. Int. Ed.等刊物发表SCI收录论文百余篇;申请国家发明专利14项,并已授权转化2项,其中1项已投入大批量生产;获省部级自然科学一等奖1项、技术发明特等奖1项。