
2021年4月22日,国际权威期刊《Nature Communications》在线刊登了我室汪贻广研究团队的最新研究成果“Quantitative imaging of intracellular nanoparticle exposure enables prediction of nanotherapeutic efficacy”。
近年来,纳米药物在癌症治疗中发挥越来越重要的作用。然而,癌症患者的肿瘤异质性使得同一种纳米药物在不同肿瘤类型甚至同种类型不同个体间均表现出较大治疗响应差异,低响应性亚群掩盖了整体治疗效果,导致纳米药物的临床转化成功率较低。传统的定量方法只能提供纳米药物的宏观组织分布,而不能区分细胞内摄取的纳米药物与细胞外及血管中分布的纳米药物。越来越多的证据表明:纳米载体的细胞摄取及其胞内转运途径对于细胞内靶点的药物生物利用度及药效发挥具有决定性作用。因此,发展新型智能递送技术,解析纳米药物在活体动物的细胞内外分布与细胞内摄取效率,进而对癌症病人进行筛选,实现个体化治疗具有重要的临床指导意义。
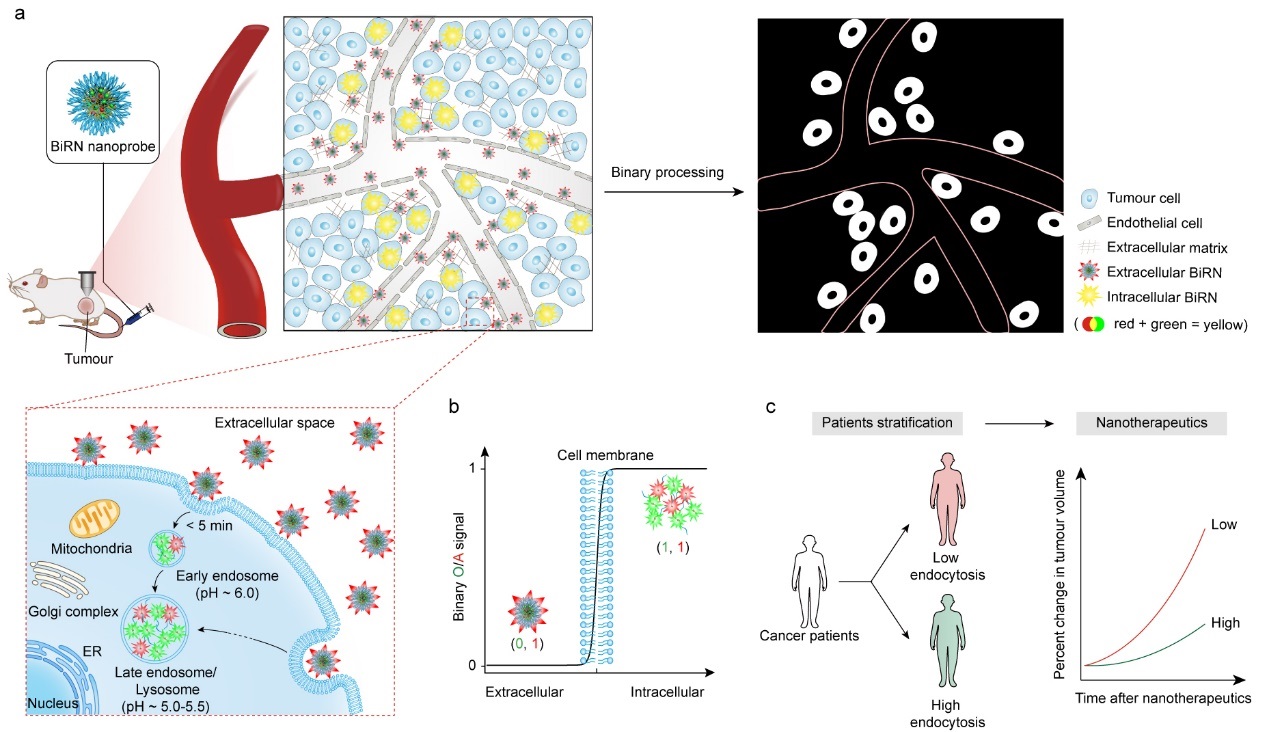
基于以上科学问题,汪贻广研究团队以内吞过程中pH值下降为响应信号设计并构建了一种二元比率成像纳米探针(BiRN),它由“常亮式”荧光模块和“关-开”荧光模块构成。静脉注射后,“关-开”荧光模块在血液和肿瘤细胞外间隙液(pHe ~ 6.5-6.8)中保持“关闭”;当纳米药物被细胞摄取进入到早期内涵体(pH ~ 6.0)后,“关-开”荧光模块信号迅速“打开”,报告纳米药物“内吞事件”的发生;而在整个体内过程中,“常亮式”荧光模块的荧光信号保持不变。通过二进制比率数据处理,肿瘤血管及细胞外分布的纳米粒信号被完全消除,从而实现对活体动物肿瘤内纳米药物的动态内吞效率和内吞量的定量化成像。采用该项技术,他们首次发现:① 静脉注射24 h,10.7-28.2%的肿瘤蓄积纳米粒被肿瘤细胞及相关细胞摄取,并且不同类型肿瘤的内吞效率具有很大差异;② 以肿瘤内纳米粒的细胞内吞量代替肿瘤内纳米粒蓄积量(EPR效应)对肿瘤病人进行分级和抗肿瘤效应进行预测,具有更好的相关性。该项研究为评估新型纳米药物的肿瘤靶向性和癌症患者分级及个性化治疗提供了有力的工具。

左起:殷晴晴(博士研究生)、汪贻广(研究员)
汪贻广研究员为本研究论文的通讯作者,博士研究生殷晴晴为论文的第一作者。该项研究得到了科技部重点研发计划、国家自然科学基金和北京市自然基金杰出青年科学基金等的资助。
原文链接:https://www.nature.com/articles/s41467-021-22678-z
【作者简介】

汪贻广,博士,北京大学研究员、博士生导师,药学院药剂学系主任、天然药物及仿生药物国家重点实验室PI,入选国家海外高层次人才。主要从事智能纳米药物递送及疾病诊疗研究,取得了一系列创新性成果,以第一作者或通讯作者在Nat. Mater.、Nat. Commun.、Angew. Chem. Int. Ed.、Adv. Mater.、Adv. Funct. Mater.、Adv. Sci.、Nano Lett.等国际著名期刊上发表SCI学术论文50余篇。作为负责人获得国家自然科学基金“优秀青年科学基金”、北京市自然基金“杰出青年科学基金”、国家重点研发计划等资助。先后获得2015年中国药学会-中恒青年药剂学奖、2017年中国药学会-赛诺菲青年生物药物奖。目前担任中国药学会药剂学专委会委员、中国药学会纳米药物专委会委员等。
(编辑:宋书香)