
近日,学术期刊《Angewandte Chemie International Edition》在线发表了我室汤新景研究团队题为“Efficient Inhibition of SARS-CoV-2 Using Chimeric oligonucleotides through RNase L Activation”(RNase L招募性嵌合反义核酸实现SARS-CoV-2 病毒RNA高效降解)的研究成果。
在细胞天然抗病毒免疫过程中,核糖核酸酶L(RNase L)是一种在脊椎动物细胞中广泛表达、具有单链RNA内切活性的蛋白质。被特异性配体2'-5' poly(A) (2-5A)招募激活后,RNase L可识别并切割单链RNA上的UN^N (N=A, U, C, G)位点并进一步诱导细胞分泌具有抗病毒活性的干扰素(IFN),以正反馈方式增强抗病毒免疫。而反义核酸(Antisense oligonucleotides)是一类寡聚核苷酸序列,其可以序列特异性地与靶标RNA结合,实现高效的寻靶和抑制活性。通过骨架修饰和末端偶联RNase H结合寡聚物2'-5' poly(A),可实现RNase L招募性和靶标RNA亲合性的统一,从而构建出基于核酸水解靶向嵌合分子技术(Nucleic Acid-hydrolysis TArgeting Chimera, NATAC)的靶标RNA降解。NATAC技术具有灵活靶向特定致病RNA、设计规律性强、药效机制明确的优势。
由此,汤新景教授团队设计构建了一类靶向SARS-CoV-2包膜蛋白RNA (E-RNA)和刺突蛋白RNA (S-RNA)的NATAC单链嵌合反义寡聚核苷酸。通过在2’甲氧基修饰的反义核酸序列的5’端缀合RNase L招募基团2-5A,可实现有效的病毒RNA降解并抑制病毒增殖。
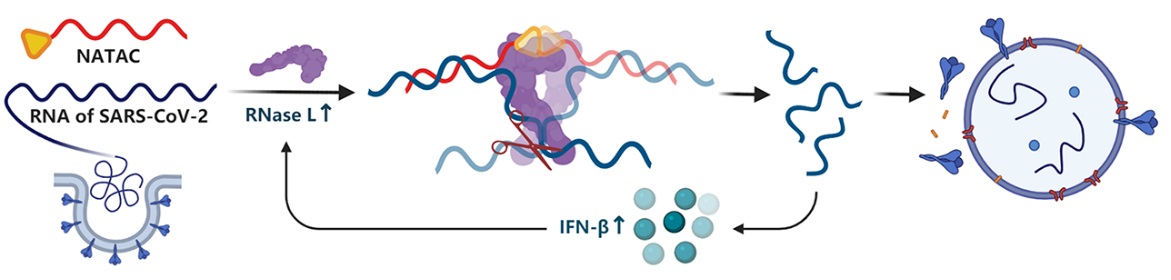
由于RNase L被激活后具有强烈的单链RNA切割活性,上述NATAC寡聚核苷酸可在低于对照反义核酸的浓度下快速降解病毒RNA并反馈上调RNase L转录水平。同时,在SARS-CoV-2假病毒感染模型中,靶向S-RNA的一条嵌合寡核苷酸在中等浓度(40 nM)下即可有效抑制假病毒组装和感染宿主细胞;由于他们靶向的是新冠病毒的保守序列,对于携带N501Y和/或ΔH69/ΔV70氨基酸突变(均为B.1.1.7毒株所携带)的SARS-CoV-2假病毒,其仍具有非常显著的抑制活性。通过导向激活RNase L,该研究设计构建的NATAC分子不仅提升了经典反义核酸对靶mRNA的降解效率,还能通过上调IFN-β等细胞因子的转录水平继续激活细胞的天然免疫过程。该NATAC技术有望与核酸肺部递送研究结合,以应对不断突变的SARS-CoV-2其抗病毒药物研发。
该工作得到北京大学周德敏教授团队在假病毒实验方面的大力支持。该研究获得国家自然科学基金委、国家重大新药创制专项等项目资助。北京大学药学院硕士研究生苏晓璇和博士研究生马闻箫为本研究论文的共同第一作者,汤新景教授为论文的通讯作者。
原文链接:https://doi.org/10.1002/anie.202105942
【作者简介】
博士,北京大学教授,博士生导师,天然药物及仿生药物国家重点实验室PI。长期从事核酸化学生物学、核酸药物精准修饰和以核酸为靶头的新型肿瘤诊疗纳米探针的研究。以通讯作者或第一作者在Angew. Chem. Int. Ed., J. Am. Chem. Soc., Nucleic Acids Res., Anal. Chem. 等国际重要学术刊物上发表论文近80篇。2010 年入选教育部新世纪人才支持计划;2014年获得国家自然科学基金委“优秀青年科学基金”。曾获中国药学会施维雅青年药物化学奖(2013)和中国药学会以岭生物医药青年奖(2017)。