2017年4月6日,国际著名学术期刊《Cell》在线发表北京大学邓宏魁研究团队题为“Derivation of Pluripotent Stem Cells with In Vivo Embryonic and Extraembryonic Potency”的研究论文。该研究在国际上首次建立了具有全能性特征的多潜能干细胞系,获得的细胞同时具有胚内和胚外组织发育潜能。
发育生物学研究的一个根本性的科学问题是如何在体外建立具有发育为整个生命个体能力的干细胞系,其代表性工作是多能(pluripotent)干细胞的建立。多能干细胞最重要的功能特性是能嵌合进入早期胚胎中并参与胚胎各个细胞谱系的发育。但是多能干细胞的发育潜能仅限于胚胎内的组织,很难发育为胎盘、卵黄囊等胚胎外的组织。如何在体外建立并维持具有胚内和胚外发育潜能的干细胞系,是当前干细胞研究领域最富挑战性的难题之一。
邓宏魁研究团队通过化学小分子筛选,开发了一种全新的培养体系,能够建立具有胚内和胚外发育潜能的小鼠和人干细胞系。这一全新的干细胞被命名为潜能扩展的多能干细胞(Extended Pluripotent Stem Cells),简称为EPS细胞。令人惊奇的是,单个小鼠EPS细胞即可高效地嵌合到小鼠不同发育时期的胚内和胚外组织中,并发育形成各种胚内和胚外的组织类型。通过四倍体补偿技术,进一步证明了单个小鼠EPS细胞即能发育成为成体小鼠。该研究团队还利用人鼠异种嵌合技术,分析了人EPS细胞的体内发育潜能。人EPS细胞注射到早期小鼠胚胎后,能够稳定地嵌合到小鼠胚内和胚外组织中,其胚内整合比例比已报道的整合效率提高了近20倍,并在mRNA和蛋白水平证明了人嵌合细胞能够向不同的细胞谱系分化。上述结果表明EPS细胞同时具有胚内和胚外的发育潜能。
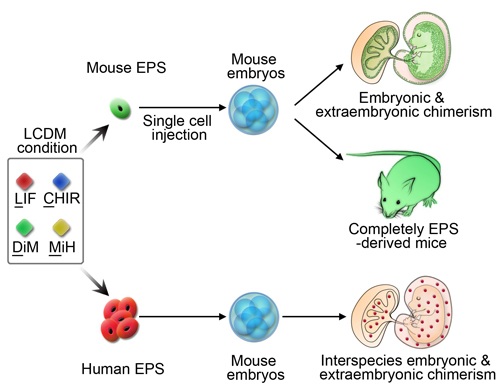
EPS细胞具有胚内和胚外的发育潜能
该项研究首次在体外建立了同时具有胚内和胚外发育潜能的干细胞系,即EPS细胞。EPS细胞为研究哺乳动物早期胚胎尤其是胚外组织发育的分子机制提供了新的工具。小鼠EPS细胞在单细胞水平所展现出的更强的嵌合能力和发育潜能,为建立小鼠遗传模型提供了新的手段。人EPS细胞的异种嵌合能力为未来利用异种嵌合技术制备人体组织和器官奠定了基础,为干细胞技术治疗重大疾病提供了新的可能。此外,采用同一培养条件即能建立人和小鼠EPS细胞,提示了EPS这一状态在哺乳动物不同物种中可能存在保守性,为未来在多个物种中广泛建立具有全能性特征的干细胞系提供了新的起点,对于干细胞研究具有重要的意义。
邓宏魁教授为本文的通讯作者,合作课题组Salk研究所的Juan Carlos Izpisua Belmonte教授以及北京大学人民医院生殖中心的沈浣教授为共同通讯作者;杨杨、刘蓓、徐君、王金琳、吴军为本文共同第一作者。本工作获得了国家重点研发计划、国家自然科学基金创新研究群体、北大-清华生命科学联合中心、北昊干细胞与再生医学研究院等的大力支持。
原文链接:http://www.cell.com/cell/fulltext/S0092-8674(17)30183-6