2022年,我室张强/何冰/代文兵/王学清团队连续在纳米递送研究领域取得重要成果,目前已在Advanced Materials(IF=32.086)、Bioactive Materials(IF=16.874)、Nanoscale Horizons(IF=11.684)等国际权威学术杂志上发表了一系列研究文章,简要回顾如下。
一、基于光催化邻近标记技术构建纳米颗粒-血浆蛋白快速动态相互作用图谱
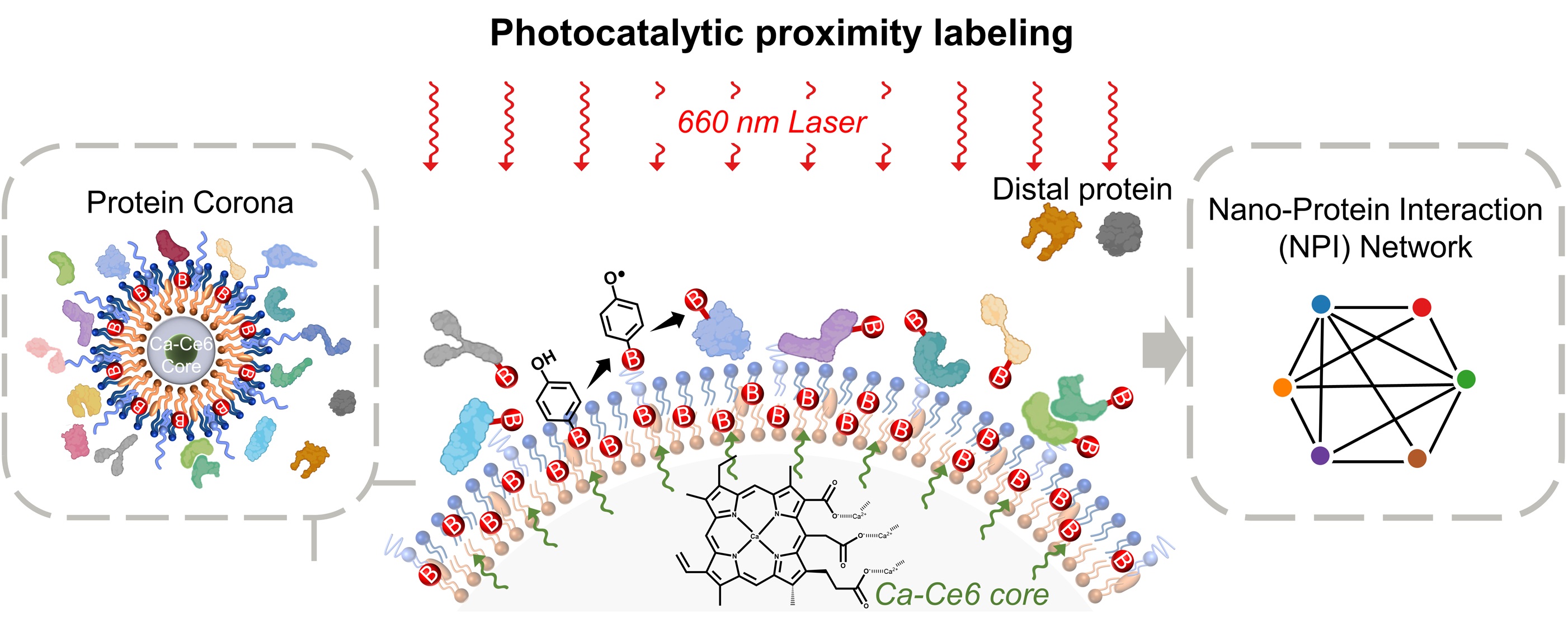
纳米药物入血后会快速与血浆蛋白发生相互作用,并在纳米粒表面形成蛋白冠,蛋白冠会对纳米药物的体内命运产生广泛影响。虽然已有大量研究通过离心等多种策略对蛋白冠进行了研究,但解析秒级时间分辨率下的蛋白冠形成机制和动态结构仍存在巨大挑战。
该研究搭建了纳米粒光催化邻近标记技术平台(nano-PPL),以达到对全时段原位蛋白冠形成机制和动态结构的解析。nano-PPL技术是通过构建共包载有光敏剂二氢卟吩e6(Ce6)和蛋白标记底物生物素-苯酚(BP)的核壳式纳米粒(NPs@CeBP)实现的。其原理为:当NPs@CeBP被激光照射时,位于内核中的Ce6接收能量并激活外层中的BP,被激活的BP自由基可以快速共价偶连在纳米粒表面吸附的蛋白上,被BP标记的蛋白经磁珠分选后可使用蛋白质组学等手段鉴定。
Nano-PPL技术将经典离心策略的30秒时间分辨率提升至5秒,并可同时满足原位分析。研究中使用超高分辨荧光显微镜等手段对nano-PPL的标记范围进行了优化和测定,并利用生物信息学分析等方式对被标记蛋白进行了筛选,以保证对蛋白冠蛋白的准确全面解析。该研究应用nano-PPL技术构建了不同电位纳米粒的蛋白冠快速动态图谱,并验证了快速形成的蛋白冠对纳米颗粒-细胞早期相互作用的影响。总之,nano-PPL技术可广泛应用于各种纳米粒与蛋白相互作用的体外检测中,并可拓展至纳米药物体内递送全过程中的纳米颗粒-蛋白快速相互作用研究。
该论文发表于Advanced Materials,药学院2018级直博生张子斌为论文第一作者,张强教授和何冰研究员为共同通讯作者。
二、酶响应可形变的多肽-光敏剂偶联物用于乳腺癌的光免疫治疗
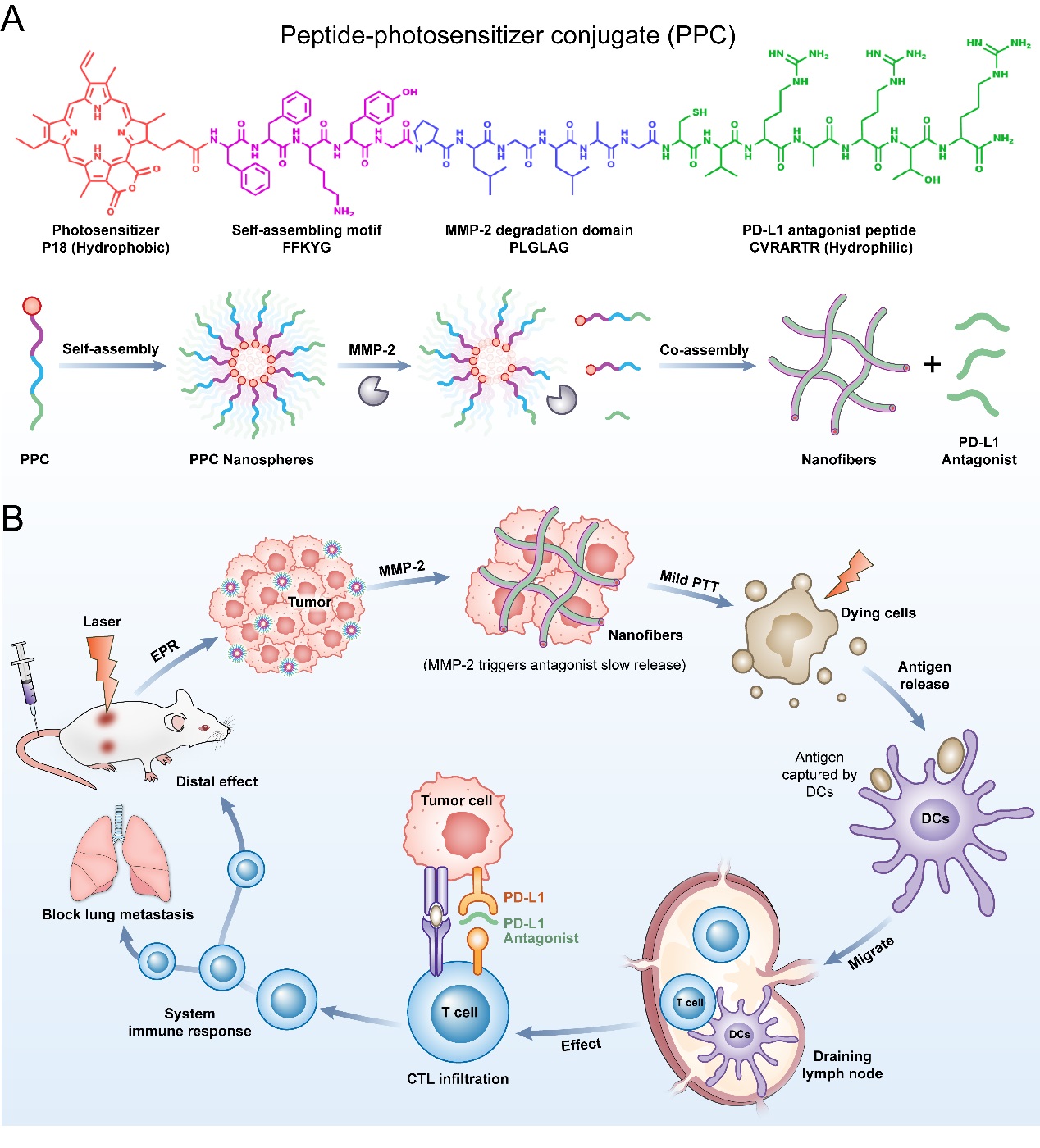
乳腺癌由于其复杂性和高转移性,仍然是一种发病率和死亡率很高的疾病。由于温和光热疗法联合免疫检查点抑制剂治疗晚期或转移性癌症方面具有良好的治疗效力受到了研究者越来越多的关注。然而,将这两种疗法进行整合并使其具有临床转化潜力仍然是一个挑战。
该研究设计了一种由PD-L1拮抗肽、MMP-2特异性酶解序列、自组装多肽基序和光敏剂Purpurin 18构成的多肽-光敏剂偶连物(PPC)。单组分PPC可自组装形成纳米粒,适合于静脉注射。当该纳米粒在肿瘤部位聚集时,PPC纳米粒被肿瘤部位高表达的MMP-2酶降解,从而启动肿瘤特异性的PD-L1拮抗肽释放。同时,该纳米粒逐渐转变为共组装的纳米纤维,从而促进了未被降解的PPC在肿瘤内的滞留。体内研究表明,PPC纳米载体在激光照射下促进细胞毒性T淋巴细胞的浸润和DC的成熟,从而使4T1肿瘤细胞对免疫检查点阻断疗法敏感。因此,PPC纳米粒在原位和远端都能有效抑制肿瘤生长,并阻止肺转移的形成。基于多肽自组装工具,该研究为乳腺癌光免疫治疗提供了一种简单有效的联合策略。
该论文发表于Bioactive Materials,药学院博士后孙亚楠和2016级长学制学生吕博晨为论文的共同第一作者,代文兵副教授、张强教授和王学清研究员为共同通讯作者。
三、纳米粒与胞外脂质结构结合调控肿瘤细胞迁移
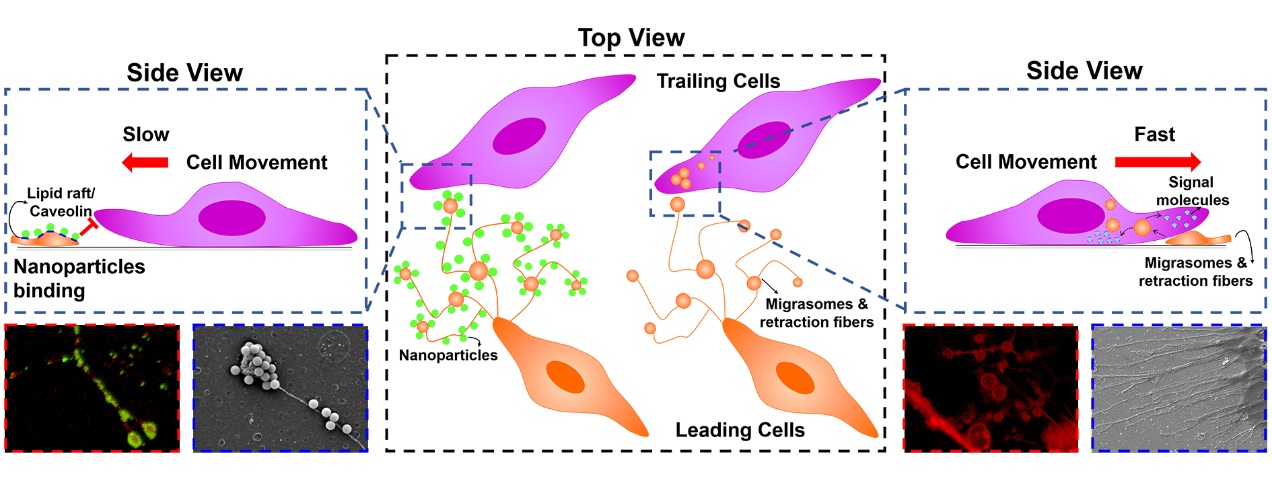
细胞外基质 (extracellular matrix, ECM) 是肿瘤微环境的重要组成成分之一。最近的研究发现,除蛋白质和多糖外,肿瘤细胞还会将脂质成分(如细胞外囊泡)分泌到肿瘤微环境中。通过与基质蛋白协同,这些脂质结构诱导周边细胞的识别和摄取,调控肿瘤细胞的迁移。从广义上讲,这些脂质结构也可以被视为一种特殊的细胞外基质成分。目前的研究中对于纳米-ECM相互作用机制不够完整和透彻的了解极大地限制了纳米药物向肿瘤细胞的有效递送。
基于以上科学问题,该研究探索了纳米药物和细胞外基质之间的相互作用特征。通过经典的细胞迁移实验以及基于高内涵成像技术的对细胞形态和运动的分析,首次发现纳米粒与细胞外基质中特定类型的脂质成分紧密结合,即收缩纤维(retraction fibers, RFs)和迁移体(migrasomes)。迁移体是近年来发现的一种新的囊泡结构的细胞器,它可以通过调节胞质内容物的释放来介导细胞功能。该研究发现,纳米粒与收缩纤维和迁移体的这种相互作用会改变细胞形态,限制细胞运动范围并影响细胞在基底上的粘附。基于这些作用,纳米粒在体外实验中被证明可以抑制肿瘤细胞的迁移,并且它们在小鼠体内抗肿瘤转移的潜力也得到了初步证实。该研究中的发现可能代表了一种纳米粒与胞外基质相互作用的普遍性机制。此外,纳米粒与收缩纤维和迁移体相互作用对细胞迁移的抑制也提出了针对这些脂质结构的抗转移纳米治疗的潜在靶点和策略。
该论文发表于Nanoscale Horizons,药学院2015级长学制学生成羽溪为论文第一作者,张强教授和何冰研究员为共同通讯作者。
【通/讯/作/者/简/介】

张强 教授
北京大学特聘教授,分子药剂学与释药系统北京市重点实验室主任,教育部创新团队负责人,中国药学会常务理事,中国药学会纳米药物专业委员会副主任委员,国家药典委药制专业委员会副主任,《药学学报B》副主编,《Journal of Controlled Release》编委等。作为CRS中国分会的首任主席,长期从事纳米药物研究,在Nature Nanotechnology、Advanced Materials、Nature Communications、Advanced Functional Materials、Nano Today、ACS Nano、Advanced Drug Delivery Review、Biomaterials、Journal of Controlled Release等发表300多篇SCI论文。负责完成创新制剂研究30余项,申请国内外发明专利50多项,开发上市多个新型释药系统,产生重大经济与社会效益。获国家与省部级科技成果奖多项。
研究兴趣:分子药剂学与创新制剂临床转化,包括难溶药物、抗癌药物、大分子药物的新型递送系统的基础研究与临床转化等。

何冰 研究员
长期从事纳米药物递送研究,以第一作者或通讯作者在Advanced Materials、Advanced Drug Delivery Review、Nature Communications、Nano Today、ACS Nano、Biomaterials、Nanoscale Horizons等权威期刊上发表研究论文多篇。目前承担1项国家自然科学基金项目,参加了国家973计划等多项研究课题。在国内外较早开始从纳米生物学角度开展纳米药物载体跨细胞转运机制的研究工作,阐明了一系列纳米药物特有的转运通路及调控规律,相关研究被国外专家评价为领域内“里程碑式的研究”。近年来又率先将多组学技术应用于该领域,在国内外提出了纳米系统生物学的概念与策略,在基于分子层面的纳米-机体相互作用方面取得了诸多新发现,逐步建立了具有自身特色的纳米药物评价体系。
研究兴趣:纳米生物学与分子药剂学,包括纳米材料与机体(细胞)相互作用的分子调控机制,纳米载体细胞转运的信号调控网络等。

代文兵 副教授
现任药剂学系副主任,长期从事药物递送的基础与转化研究。承担国家重点研发计划课题、国家自然科学基金项目和国家新药重大专项等国家级科研项目;以第一作者或通讯作者在 Advanced Functional Materials、Bioactive Materials、Journal of Extracellular Vesicles、Biomaterials、Journal of Controlled Release、Advanced Drug Delivery Review等期刊上发表多篇论文;担任Asian Journal of Pharmaceutical Sciences青年编委,Pharmaceutics编委;作为主要完成人,获得1项国家科技进步二等奖和1项教育部自然科学一等奖;获得国内外专利授权13项,多项已完成转让,并获得2项改良型新药的临床批件;多次参加CDE新药评审会(化药和生物药),起草或参与起草了包括《纳米药物质量控制研究技术指导原则》等多项技术指南。
研究兴趣:基于多肽自组装的药物递送研究;单抗药物递送;难溶性药物纳米化新策略及转化研究等。

王学清 研究员
主持国家自然科学基金5项,北京市自然科学基金2项,多次参加973、863、国家重大新药创制等项目。以第一作者或通讯作者在Advanced Drug Delivery Review、Biomaterials、Journal of Controlled Release等期刊发表论文60余篇,授权国家发明专利7项。获国家科技进步奖二等奖,教育部自然科学奖一等奖、二等奖,北京市科学技术奖二等奖等省部级以上奖励6项。
研究兴趣:纳米药物跨生物屏障转运机制及生物学效应。
【相关文献】
1. Zhang, Zibin, Junji Ren, Wenbing Dai, Hua Zhang, Xueqing Wang, Bing He, and Qiang Zhang. 2022. "Fast and Dynamic Mapping of the Protein Corona on Nanoparticle Surfaces by Photocatalytic Proximity Labeling." Advanced Materials n/a (n/a):2206636. doi: https://doi.org/10.1002/adma.202206636.
2. Sun, Yanan, Bochen Lyu, Chang Yang, Bing He, Hua Zhang, Xueqing Wang, Qiang Zhang, and Wenbing Dai. 2023. "An enzyme-responsive and transformable PD-L1 blocking peptide-photosensitizer conjugate enables efficient photothermal immunotherapy for breast cancer." Bioactive Materials 22:47-59. doi: https://doi.org/10.1016/j.bioactmat.2022.08.020.
3. Cheng, Yuxi, Junji Ren, Shumin Fan, Peiyao Wu, Wenshu Cong, Yuxing Lin, Shaojie Lan, Siyang Song, Bin Shao, Wenbing Dai, Xueqing Wang, Hua Zhang, Bo Xu, Wenzhe Li, Xia Yuan, Bing He, and Qiang Zhang. 2022. "Nanoparticulates reduce tumor cell migration through affinity interactions with extracellular migrasomes and retraction fibers." Nanoscale Horizons 7 (7):779-789. doi: https://doi.org/10.1039/d2nh00067a.
(编辑:宋书香)