胆固醇是细胞膜的关键组分,其代谢紊乱与心血管疾病、神经退行性疾病及肿瘤等密切相关。溶酶体表面是胆固醇激活mTORC1信号通路的核心场所,但长期以来,胆固醇如何被感知并转化为下游信号的分子机制尚未阐明。LYCHOS(又称GPR155)作为溶酶体膜上特异性胆固醇感受器,此前被证实可响应胆固醇浓度变化并调控mTORC1活性,然而其识别胆固醇浓度结构基础与动态构象变化一直未知。
2025年7月23日,我室梁令团队联合孙金鹏教授团队在Nature Communications杂志在线发表题为 “Structural insights into cholesterol sensing by the LYCHOS-mTORC1 pathway” 的研究论文。该研究利用冷冻电镜技术解析了人源LYCHOS在胆固醇及其类似物存在或缺失条件下的六种高分辨率结构,揭示了LYCHOS通过构象变化识别胆固醇浓度并调控mTORC1信号的完整分子机制,为靶向mTORC1通路的选择性药物开发奠定了结构基础。

研究团队通过单颗粒冷冻电镜解析了LYCHOS在胆固醇类似物CHS结合下的“收缩状态”(contracted state)及CHS缺失时的“扩张状态”(expanded state)(图1)。结构显示,LYCHOS以同源二聚体形式存在,每个单体由17次跨膜螺旋组成,分为通透性结构域(PLD)和GPCR样结构域(GLD)。在胆固醇结合后,GLD向PLD发生刚性旋转,带动跨膜螺旋TM15的胞质端外移,暴露关键酪氨酸残基Tyr551,从而招募复合物GATOR1,解除其对Rag GTP酶的抑制,最终激活mTORC1。
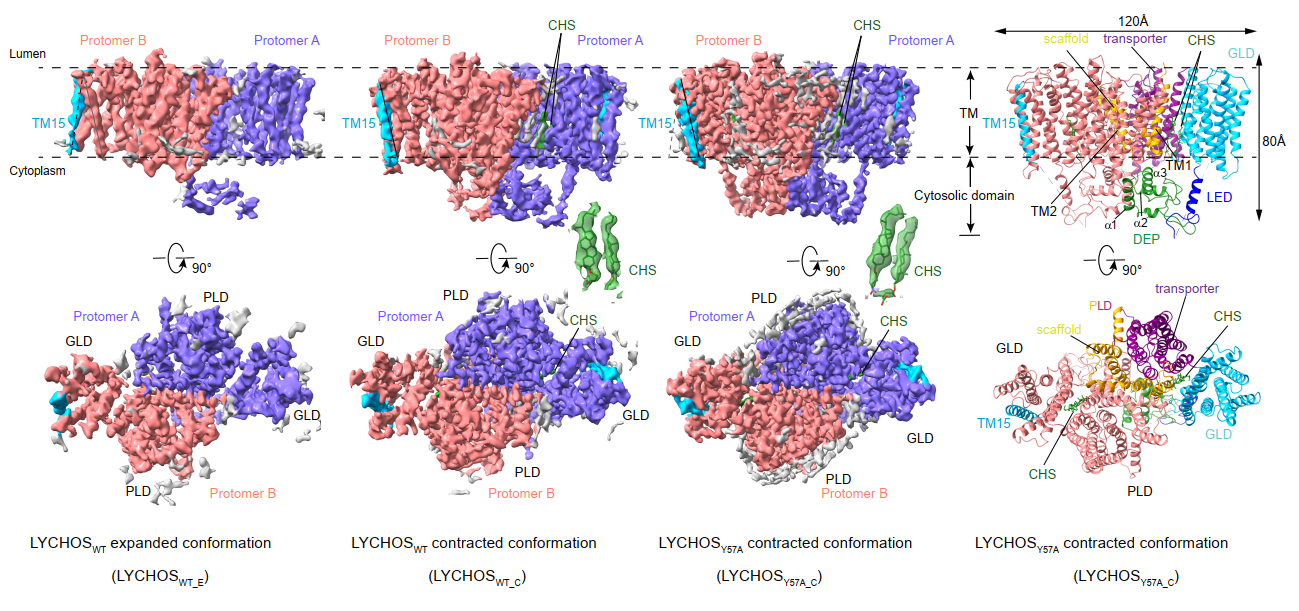
图1 LYCHOS冷冻电镜结构
进一步功能实验发现,胆固醇结合口袋(CBS1/CBS2)中的Tyr57、Phe50、Phe352等残基突变显著削弱LYCHOS对胆固醇的响应能力;而G702L、G702F、G702M突变则增强了LYCHOS对胆固醇的结合能力(图2)。此外,分子动力学模拟及分子内FlAsH-BRET证实,LYCHOS在胆固醇结合后由扩张状态转变为收缩状态,Tyr551从膜内嵌入状态转变为暴露状态,为GATOR1提供结合位点。
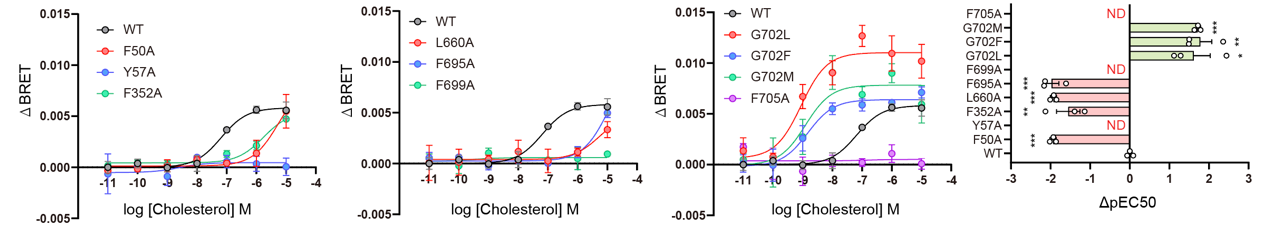
图2 LYCHOS胆固醇结合位点分析
基于上述结构与功能结果,研究者提出了LYCHOS介导的胆固醇感知与信号转导工作模型(图3):在胆固醇匮乏时,LYCHOS处于扩张状态,Tyr551埋藏于膜内,GATOR1持续抑制Rag GTP酶,mTORC1失活;当胆固醇富集时,胆固醇分子结合至LYCHOS的CBS1/CBS2位点,诱导GLD向PLD收缩,Tyr551暴露并招募GATOR1,解除其对Rag GTP酶的抑制,mTORC1得以激活并定位于溶酶体表面。
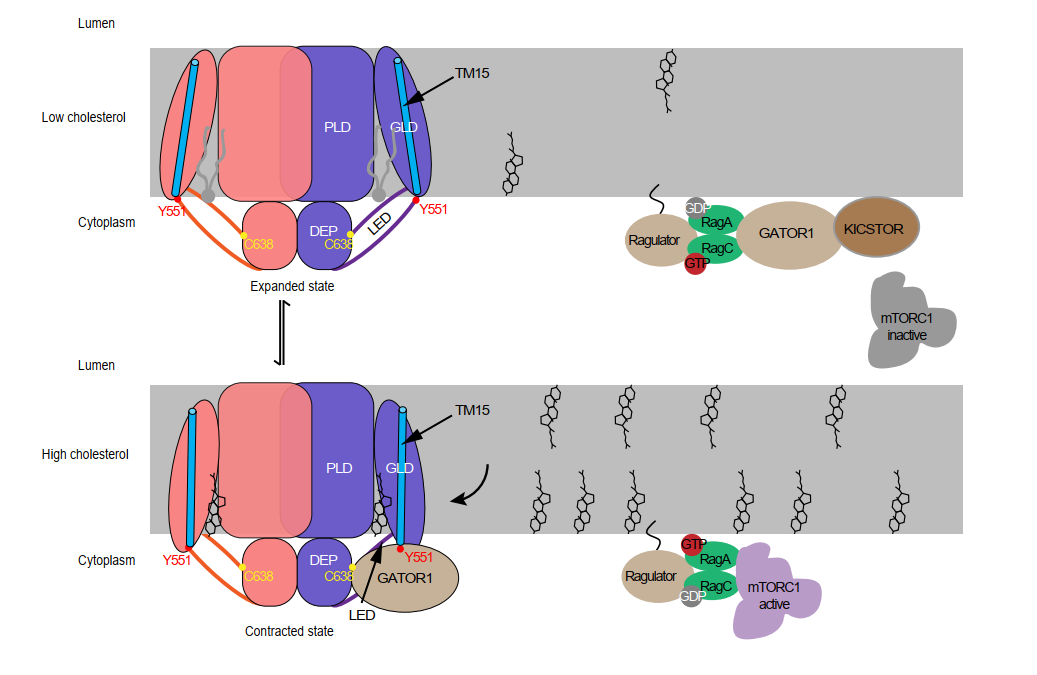
图3 LYCHOS感受胆固醇浓度并调控mTORC1活性的工作模型
相较于前期发表的LYCHOS冷冻电镜结构研究文章,该研究阐明了LYCHOS感知胆固醇浓度的动态结构基础,并揭示了其构象变化与mTORC1激活之间的直接关联。鉴于mTORC1在衰老、代谢疾病及肿瘤中的关键作用,本研究为开发特异性靶向LYCHOS构象状态的小分子抑制剂提供了理论依据和结构模板,有望实现精准调控mTORC1通路并减少副作用。
北京大学基础医学院梁令助理教授和孙金鹏教授为论文的共同通讯作者。北京大学基础医学院博士研究生於尚、丁金辉以及博士后王佳乐为论文的共同第一作者。该研究得到了北京大学基础医学院尹玉新教授团队的许多支持和帮助。
论文链接:https://www.nature.com/articles/s41467-025-61966-w