2023年6月9日,我室王韵团队在 Cancer Letters 期刊发表了题为“CDYL knockdown reduces glioma development through an antitumor immune response in the tumor microenvironment”的研究论文。文章以胶质瘤最常见的组织细胞学类型星形胶质细胞瘤来源的临床样本组织和细胞系为研究对象,揭示了CDYL在胶质瘤发生发展中的作用及机制,为胶质瘤的临床治疗提供了潜在新靶点。
该研究聚焦于胶质瘤的表观遗传调节机制。胶质瘤是一类最常见的原发性恶性中枢神经系统肿瘤。目前研究认为胶质瘤的发生受遗传和环境因素的影响。早期研究发现,基因的突变或缺失与低级别、高级别胶质瘤或继发性胶质母细胞瘤的发生有关(Zheng et al., 2008)。随着胶质瘤基础研究的不断深入,人们发现后天环境因素导致的表观遗传水平改变在胶质瘤发生中更为常见。目前研究发现的胶质瘤患者的表观遗传因素改变中,异柠檬酸脱氢酶(Isocitratedehydrogenase, IDH)1和IDH2的突变以及组蛋白H3K27位点杂合性点突变(H3K27M)等已经作为关键的分子标志物,被纳入2016版世界卫生组织WHO对胶质瘤肿瘤的分类中,为胶质瘤的临床诊断和预后判断提供了重要参考价值,同时也为精准医疗提供了潜在治疗靶点(Komori et al., 2016)。虽然目前的分子靶向药物疗法和肿瘤免疫疗法在不同程度上可改善胶质瘤患者的生存期,但患者有时会出现敏感性不一、效果不稳定的情况。因此,深入探寻胶质瘤发生发展中的关键表观遗传调控因素非常重要。
王韵团队和合作者前期发现表观遗传因子CDYL(Chromo-domain Y like)可以促进神经元的迁移,敲除CDYL的小鼠,神经元迁移能力减弱、皮层神经元兴奋性增高、癫痫的易感性增加,提示CDYL在中枢神经系统相关疾病中可能发挥着重要作用(Qin et al., 2017)。CDYL是一种转录共抑制子,研究发现,CDYL能够与EZH2(Enhancer of zeste homolog 2)区域结合,形成异染色质,抑制众多基因的表达,进而参与多种生理病理过程的调控(Caron et al., 2003)。那么CDYL是否在中枢神经系统肿瘤中发挥着一定的作用呢?
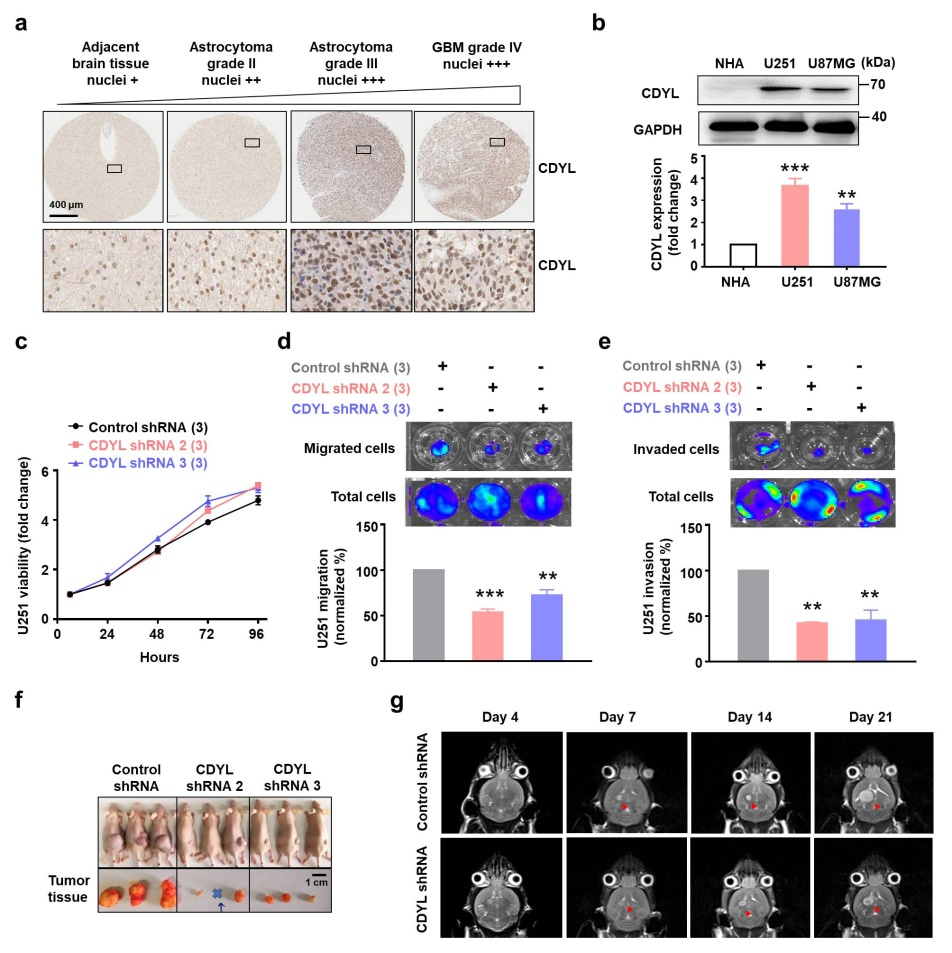
图1. CDYL参与胶质瘤的进展
在该研究中,研究团队发现人脑胶质瘤组织和细胞系中CDYL的表达上调(图1a-b)。敲低CDYL可抑制胶质瘤细胞系U251和U87MG细胞的迁移和侵袭能力,而对细胞的增殖能力没有影响(图1c-e)。但是,在体裸鼠皮下成瘤和原位胶质瘤模型实验表明,敲低CDYL可显著抑制胶质瘤的生长(图1f-g)。进一步探讨敲低CDYL抑制胶质瘤生长的机制,对肿瘤组织进行转录组RNA-seq分析和进一步实验证实,敲低CDYL可上调免疫相关通路以及趋化性细胞因子CCL2和CXCL12。免疫组化染色实验和巨噬细胞极化实验结果表明,敲低CDYL可导致肿瘤组织中M1型肿瘤相关巨噬细胞(Tumor-associated macrophages/microglia cells, TAMs)浸润增加和M2型TAMs浸润减少。此外,原位胶质瘤动物模型研究发现,原位巨噬细胞清除和CCL2抗体中和后,敲低CDYL导致的肿瘤抑制作用被减弱。
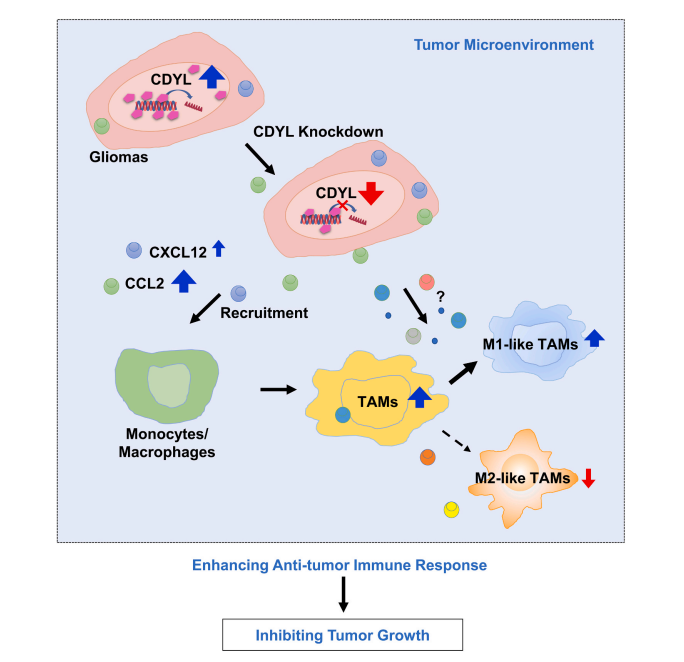
图2. 敲低CDYL抑制胶质瘤进展
综上所述,该研究揭示了胶质瘤中CDYL表达上调,敲低CDYL可抑制肿瘤的生长。该过程与敲低CDYL引起的CCL2招募的单核/巨噬细胞增加以及免疫微环境中M1型TAMs浸润增加有关。该研究首次证明了CDYL在胶质瘤及其局部免疫微环境中的作用,进一步阐明了胶质瘤发生发展的表观遗传调控机制,并为未来以CDYL为靶点的抗胶质瘤药物研发提供了依据,具有临床转化价值。
北京大学神经科学研究所孔金阁博士和梅竹博士后是该文章的并列第一作者,北京大学神经科学研究所王韵教授和免疫学系张君教授为该文章的通讯作者。该研究获得了科技部重大项目计划的资助。
论文链接:https://doi.org/10.1016/j.canlet.2023.216265
【王韵教授团队简介】

北京大学神经科学研究所教授、副所长。王韵团队主要从事神经系统细胞信号转导的研究。综合利用多学科手段,整合多种研究方法,主要进行以下两方面的工作:
1. 痛与痛觉调制细胞信号转导通路及慢性痛与精神共病分子机制和干预策略:采用慢性病理性疼痛模型,深入探讨慢性痛、相关痛相关负性情绪及痛记忆产生的特异的信号通路,以期发现新的镇痛靶点或镇痛药物。
2. 神经系统发育、损伤、修复及脑重大疾病分子机制及干预策略:探讨参与神经元极性建立、迁移、树突发育、突触形成和修剪等神经发育过程,以及外周神经损伤后修复(与发育过程享有一些共同的分子机制)和神经元缺血损伤/抗损伤过程的关键分子等,从而为一些临床常见神经系统相关疾病的治疗提出新方法。
【参考文献】
1. Zheng H, Ying H, Yan H, Kimmelman A C, Hiller D J, Chen A J, Perry S R, Tonon G, Chu G C, Ding Z, Stommel J M, Dunn K L, Wiedemeyer R, You M J, Brennan C, Wang Y A, Ligon K L, Wong W H, Chin L and DePinho R A. p53 and Pten control neural and glioma stem/progenitor cell renewal and differentiation. Nature. 2008, 455(7216): 1129-1133
2. Qin R, Cao S, Lyu T, Qi C, Zhang W and Wang Y. CDYL Deficiency Disrupts Neuronal Migration and Increases Susceptibility to Epilepsy. Cell Rep. 2017, 18(2): 380-390
3. Caron C, Pivot-Pajot C, van Grunsven L A, Col E, Lestrat C, Rousseaux S and Khochbin S. Cdyl: a new transcriptional co-repressor. EMBO Rep. 2003, 4(9): 877-882