神经可塑性是神经系统适应环境刺激、维持功能稳定性的核心机制,主要包括突触可塑性与内在可塑性。突触可塑性通过调节突触强度实现神经元之间连接的动态调整,而内在可塑性则通过控制离子通道的表达与分布,调节神经元本身的兴奋性,从而影响其对突触输入的反应能力。在癫痫等神经系统疾病中,神经元异常放电往往源于可塑性机制的紊乱,尤其表现为钠通道功能或表达的异常失衡。已有研究提示,转录因子在调控癫痫相关离子通道表达中可能发挥关键作用,但其在疾病进程中所介导的具体机制仍不清晰,特别是调控NaV1.2通道(由Scn2a基因编码)表达的转录调控网络尚缺乏系统性研究。大麻二酚(Cannabidiol, CBD)是源自 Cannabis sativa 的非致幻性植物性大麻素,近年来已被证实在难治性癫痫治疗中具有显著疗效,已成为备受关注的抗癫痫药物。研究显示,CBD 可通过多种机制,包括抑制T型钙通道和电压门控钠通道,缓解神经环路的病理性高兴奋状态。然而,其使用后引发的胞内长期转录调控效应及其具体靶点机制尚未明确。

2025年7月11日,我室黄卓团队与合作团队在Advanced Science杂志在线发表了题为 “The DEC2-SCN2A axis is essential for the anticonvulsant effects of cannabidiol by modulating neuronal plasticity” 的研究论文。该研究聚焦神经可塑性调控机制,首次系统揭示了转录因子DEC2(又称BHLHE41)在调控神经元可塑性和癫痫发作中的关键作用,构建了以DEC2为核心的转录调控轴,紧密连接神经元活动与NaV1.2钠通道表达调控。该研究首次提出并验证了“CBD通过诱导DEC2表达,抑制轴突起始段NaV1.2的表达,从而降低神经元异常兴奋性,实现长效抗癫痫作用”的创新机制。该研究首次明确了DEC2在神经可塑性中的核心贡献,为CBD临床应用及钠通道靶向干预提供了创新治疗思路。
颞叶癫痫(TLE)是一种复杂的癫痫类型,其发病机制仍未完全明晰。研究人员首先基于四种TLE大鼠模型的转录组数据,采用加权基因共表达网络分析(WGCNA)构建共表达网络,识别出与癫痫表型高度相关的关键模块及中心基因(图1A)。分析发现,DEC2在所有癫痫最相关模块中均显著富集(图1B),提示其可能为调控癫痫发生的核心基因。进一步验证表明,临床TLE患者颞叶组织中DEC2蛋白水平显著高于对照(图1C),在化学诱导的啮齿类癫痫模型中(包括卡英酸(KA)和戊四唑(PTZ)模型),DEC2的蛋白和mRNA水平在癫痫诱导后均持续升高(图1D–F)。免疫荧光显示其在癫痫皮层区域表达明显增强(图1G)。以上结果表明,DEC2在啮齿类动物和人类癫痫组织中均显著上调,提示其在TLE癫痫发生与发展中可能具有重要作用。
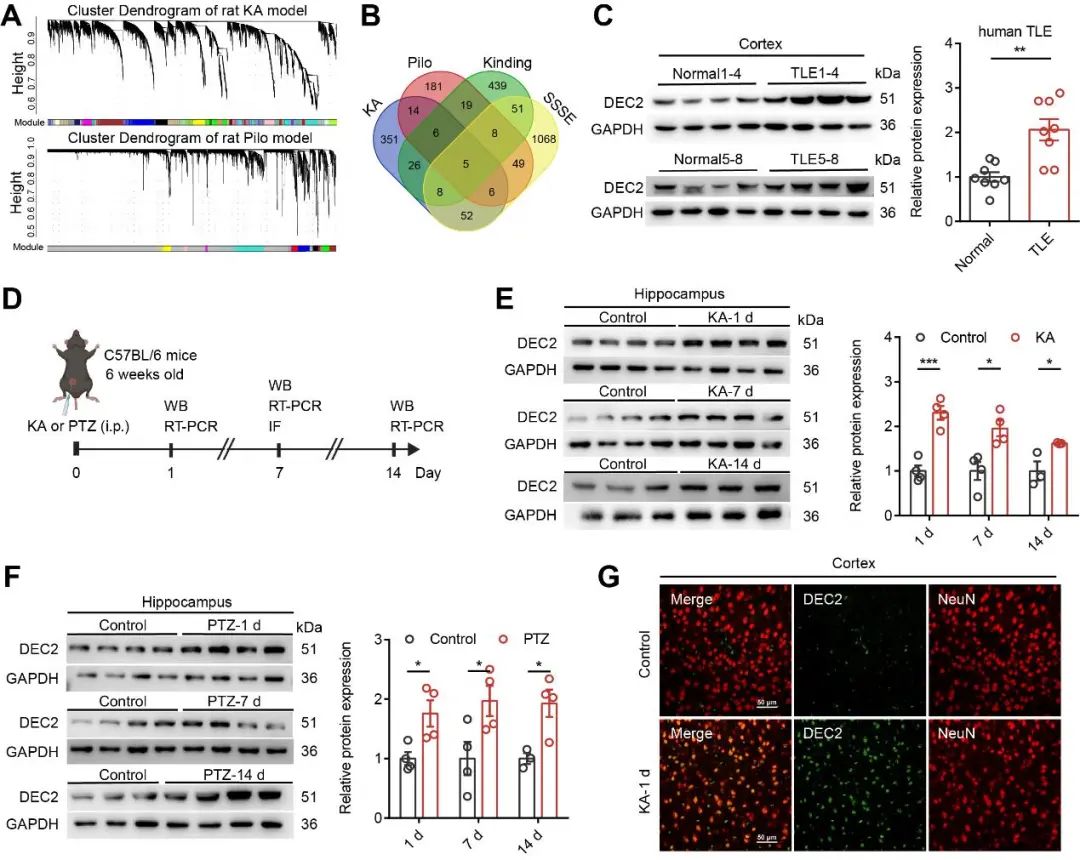
图1 DEC2在TLE患者及啮齿动物癫痫模型中表达显著上调
为了探究DEC2异常表达在体内的病理生理学功能,研究人员通过立体定位注射腺相关病毒(AAV),在小鼠海马DG区实现了DEC2的特异性敲低或过表达。行为学评估显示,在KA诱导的急性癫痫模型中,DEC2敲低显著加速癫痫发作进程,并导致发作严重程度增加(图2A–D);相反,DEC2过表达则表现出明显的神经保护效应,包括发作延迟、潜伏期延长及发作强度减弱(图2E–G)。进一步地,研究人员构建了小鼠慢性癫痫模型以评估DEC2在癫痫发作进程中的作用(图2H)。结果显示,DEC2敲低组小鼠的自发性癫痫发作潜伏期显著缩短,每日发作频率明显升高,单次发作持续时间显著延长(图2I–L)。上述结果首次证实了DEC2具有抑制癫痫发作和延缓癫痫进程的重要功能。
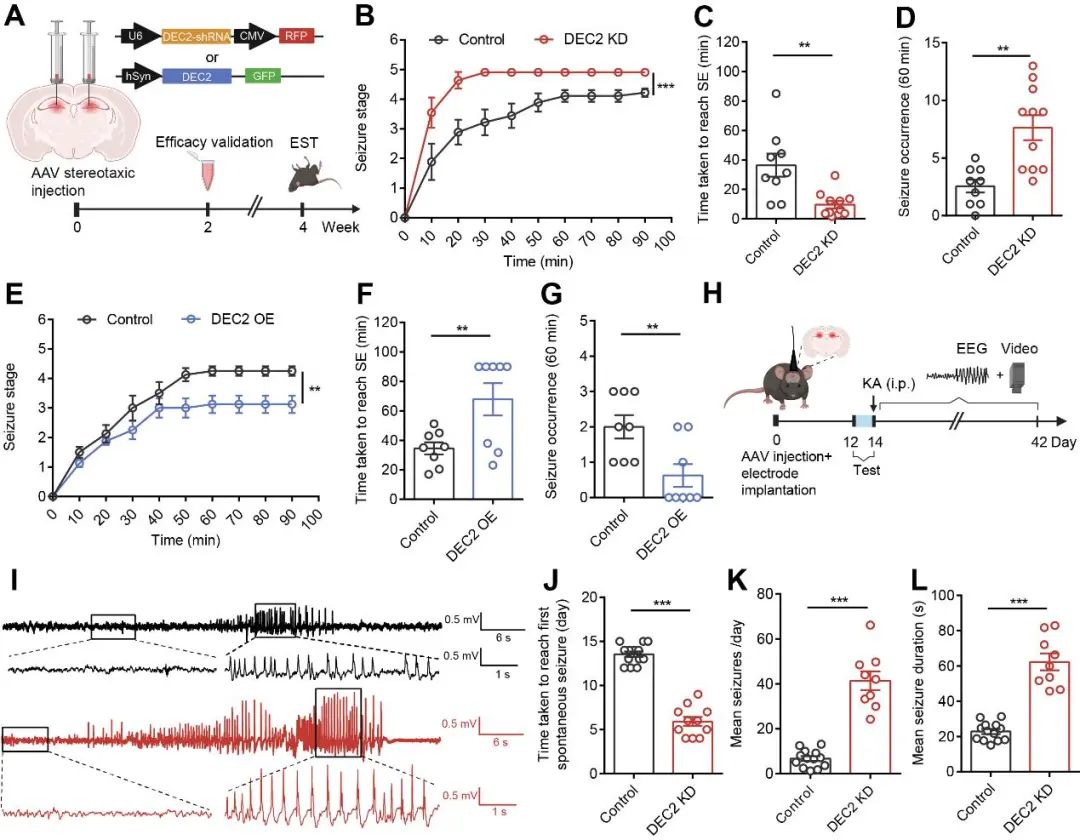
图2 DEC2抑制癫痫发作和延缓癫痫进程
癫痫通常以神经元可塑性机制的紊乱为特征。为了评估DEC2对神经元可塑性的调控作用,研究人员选择性干预小鼠海马(CA1区或DG区)DEC2的表达,并于AAV注射后第14–21天,通过全细胞膜片钳电流钳技术记录神经元的内在兴奋性变化(图3A)。结果显示,DEC2敲低显著增强了神经元的内在兴奋性,表现为动作电位(AP)发放数量增加、AP去极化速率加快及幅值增大(图B–C);相反,DEC2过表达则显著抑制神经元兴奋性(图3D–E)。在突触可塑性方面,研究人员进一步采用电压钳模式记录微小兴奋性突触后电流(mEPSCs),以评估DEC2对突触功能的影响。结果显示,DEC2显著影响了mEPSCs的事件频率,但对单个事件的幅值无显著影响(图3F–G),提示其主要通过抑制突触前神经递质释放概率以削弱兴奋性突触传递。综上结果表明,DEC2通过双重机制调控海马环路的神经元可塑性,从而在维持神经环路稳定性、抑制癫痫活动中发挥关键作用。
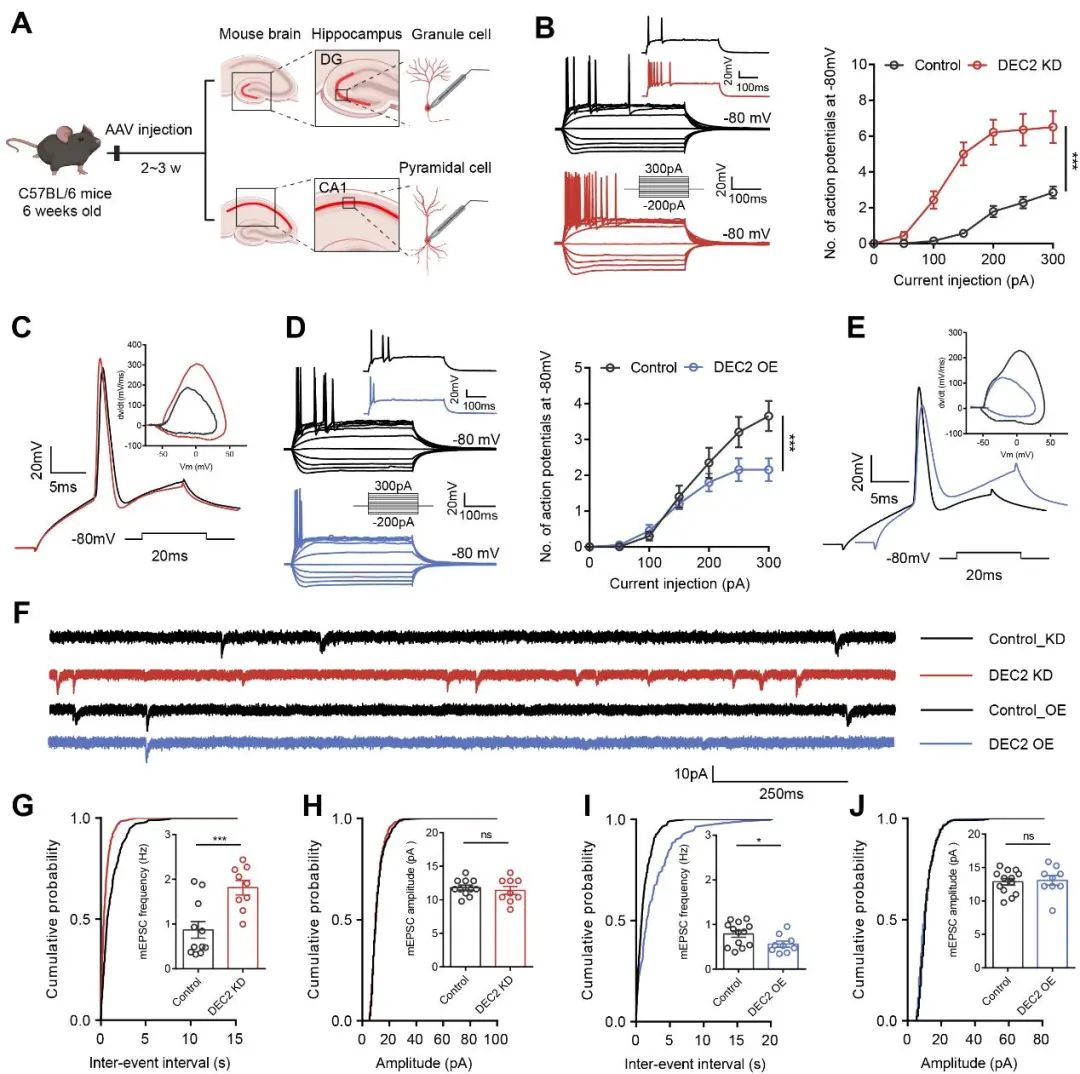
图3 DEC2抑制海马神经元的内在兴奋性及兴奋性突触活动
为了阐明DEC2在神经元可塑性及癫痫发生中的分子机制,研究人员构建了小鼠海马区DEC2敲低模型,并进行转录组测序分析,共识别出832个上调和694个下调的差异表达基因(图4A, B)。鉴于DEC2作为转录抑制因子的功能特性,分析重点聚焦于在DEC2敲低背景下显著上调的基因。结果显示,编码电压门控钠通道NaV1.2的基因Scn2a表达水平显著升高,提示其可能为DEC2的重要下游靶基因。在小鼠海马组织及原代神经元中进行DEC2敲低和过表达实验进一步验证,SCN2A与DEC2表达呈明显负相关关系(图4C),且该调控具有高度特异性,对其他动作电位相关离子通道无显著影响。结合JASPAR数据库和染色质免疫沉淀测序(ChIP-seq)数据预测,DEC2可结合Scn2a启动子区的多个E-box元件;ChIP实验证实DEC2在体内外均可特异性结合E-box 1和E-box 2位点(图4D, E)。荧光素酶报告实验显示,DEC2通过该区域显著抑制Scn2a转录活性,而突变E-box位点可削弱这一抑制效应(图4F)。进一步的免疫共沉淀和蛋白截短体实验表明,DEC2通过其DNA结合结构域直接调控Scn2a转录,而非依赖与其他转录因子(如MYOD1)相互作用(图4G–I)。功能上,全细胞膜片钳电压钳记录发现DEC2敲低显著增强NaV1.2介导的钠电流密度,且不影响电压门控特性。在NaV1.6敲除小鼠的神经元中重复实验亦得出一致结果(图4J–K),进一步验证了其对NaV1.2的特异性调控。以上结果表明,DEC2通过结合Scn2a启动子E-box区域,发挥转录抑制作用,下调NaV1.2表达和功能,从而精确调控神经元兴奋性。
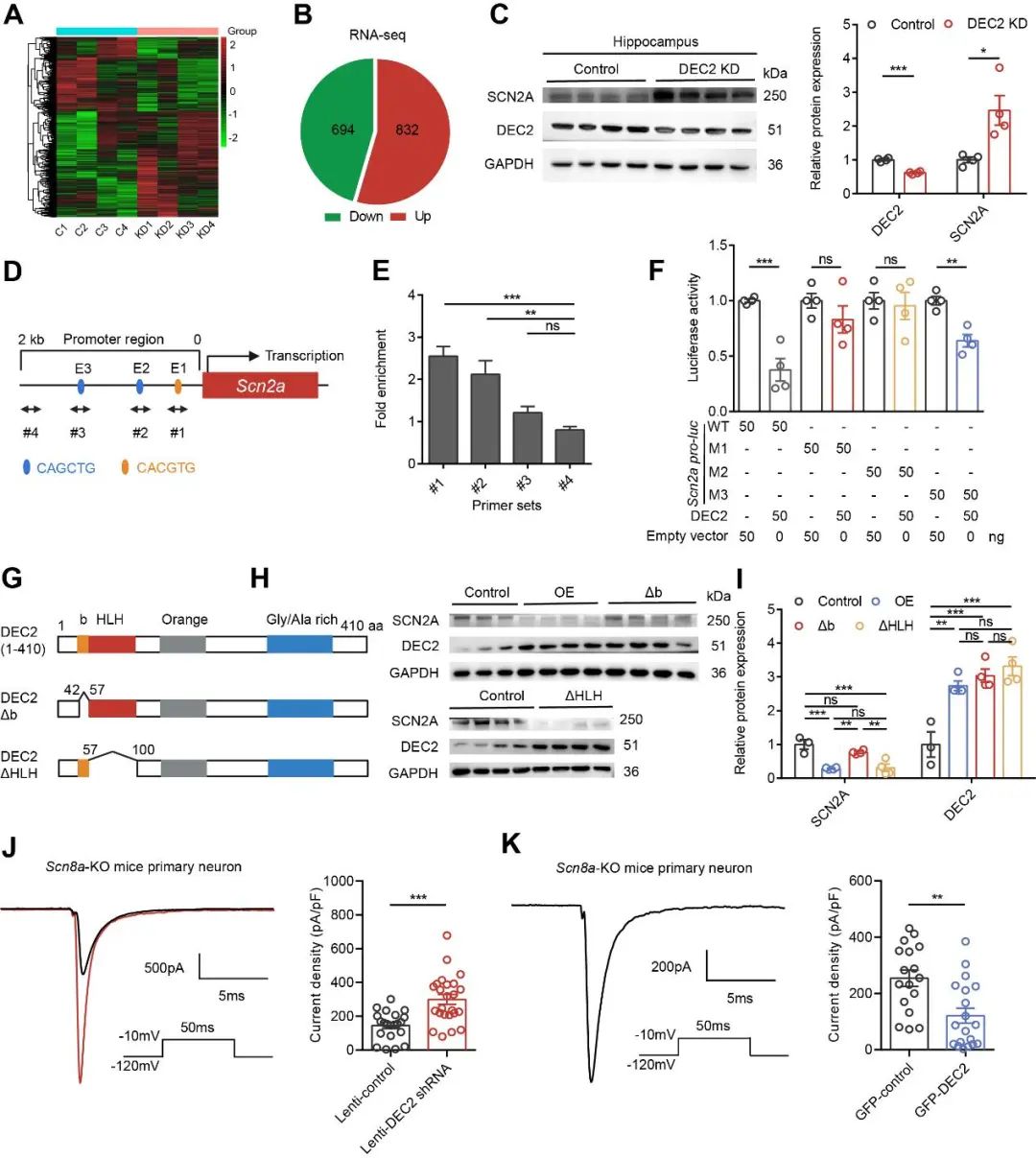
图4 DEC2通过结合Scn2a基因的启动子E-box区域直接抑制NaV1.2通道的表达
为了进一步验证NaV1.2通道在DEC2调控癫痫发生中的作用,研究人员在DEC2敲低背景下进一步敲低SCN2A表达。结果显示,SCN2A敲低显著逆转了DEC2敲低所致的神经元内在兴奋性增强、自发突触电活动频率升高等可塑性异常(图5A–E)。此外,SCN2A敲低显著改善了DEC2敲低所致的癫痫加重行为表型(图5F–I),全面证实了DEC2-SCN2A轴在癫痫发生发展中的功能价值,进一步巩固了该轴作为潜在临床干预靶点的意义。为探索DEC2-SCN2A轴的药理调控潜力,研究团队开展药物筛选,发现大麻二酚(CBD)显著上调神经元中DEC2表达,并伴随SCN2A表达下调及神经活性标志物c-fos的同步减少,提示其抗癫痫作用可能依赖于DEC2介导的调控通路。体外实验表明,CBD在低至0.1 mM的浓度下即可诱导HT22神经元中DEC2表达升高(图5J);体内给予CBD(100 mg/kg)亦可引起小鼠海马区DEC2上调及SCN2A下调(图5K–M)。进一步通过DEC2或MYOD1敲低实验验证,CBD在DEC2敲低条件下无法抑制SCN2A表达,而MYOD1敲低并不影响CBD对DEC2或SCN2A的调控,表明DEC2是CBD发挥抗癫痫效应的必要分子。以上结果明确建立了CBD通过激活DEC2-SCN2A轴抑制神经元过度兴奋,从而发挥抗癫痫作用的全新分子机制(图6)。
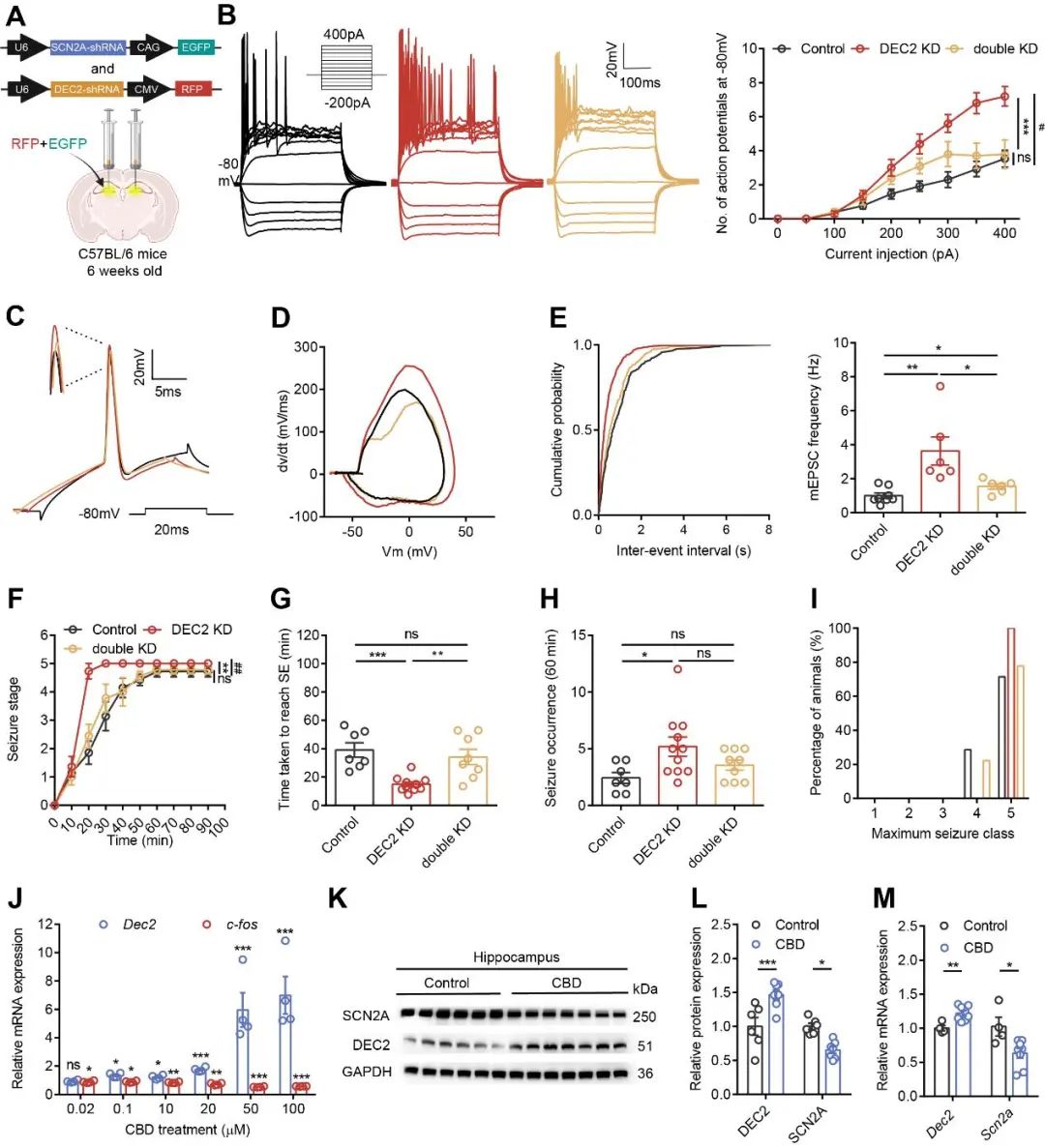
图5 CBD通过DEC-SCN2A轴发挥抗癫痫效应
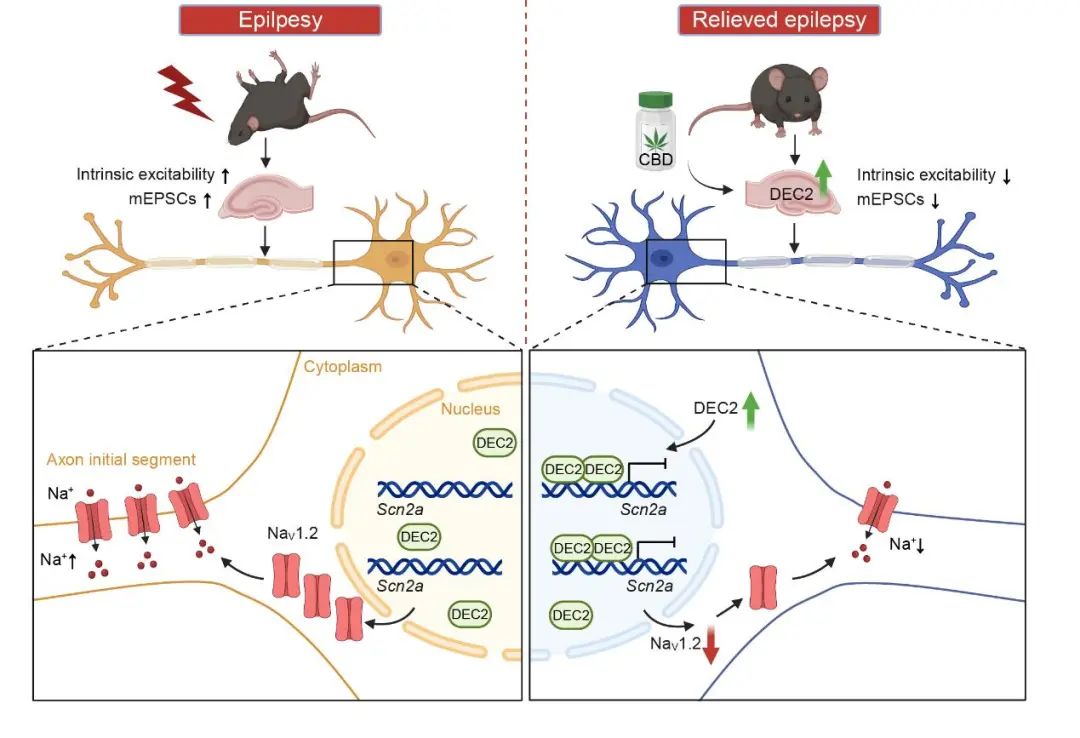
图6 机制示意图
综上,该研究通过整合生物信息学分析、转录组测序、病毒介导的基因操控、电生理记录、分子生物学技术及药物筛选等多种手段,系统揭示了转录因子DEC2作为神经元可塑性关键调控因子的功能及其作用机制。研究首次明确了DEC2通过直接抑制Scn2a基因表达,调控NaV1.2通道在轴突起始段的定位与表达,从而精细调节神经元兴奋性与突触传递,在癫痫发作过程中发挥内源性负反馈保护作用。该成果不仅填补了SCN2A上游调控网络的空缺,也深化了对bHLH类转录因子在中枢神经系统功能稳态调控中的机制认知。更为重要的是,研究构建了CBD–DEC2–SCN2A“药物–转录因子–离子通道”调控轴,进一步阐明了CBD长效抗癫痫作用的分子机制。深入解析CBD所介导的转录调控机制,不仅有助于揭示癫痫发作过程中内在可塑性的紊乱本质,也将为开发新型、机制明确的癫痫治疗策略提供重要理论依据。
北京大学药学院博士后宋慧芳为论文第一作者。北京大学药学院孙崎教授、美国普渡大学杨洋教授、中国医科大学附属盛京医院马维宁、北京大学药学院黄卓教授为论文通讯作者。该研究得到了科技部“脑科学与类脑科学”重大项目、国家自然科学基金、宁波市科技计划项目、宁夏回族自治区重点研发项目的资助。
原文链接:http://doi.org/10.1002/advs.202416315