癌症免疫疗法和免疫检查点抑制剂的出现彻底改变了肿瘤学领域,其优越疗效证明了人类免疫系统在对抗癌症方面的巨大潜力,但许多癌症患者对该创新疗法无应答,因为大多数肿瘤处于免疫“冷”状态,在很大程度上归因于几个相互交织的因素,包括相对较低的突变负荷、高度免疫抑制的肿瘤微环境(TME)和肿瘤抗原特异性CD8+ T细胞浸润较差。因此,开发新的更有效的免疫治疗策略成为当务之急。
与其它核酸疗法一样,环二核苷酸(CDN)的细胞生物利用度和体内药代动力学性能均较很差,限制了其体内活性作用发挥和临床应用。STING激动剂常用作激活固有免疫以增强抗肿瘤T细胞应答的疗法。与小分子激动剂相比,基于纳米颗粒的CDN类STING激动剂有潜在优势,包括提高对肿瘤浸润巨噬细胞和树突状细胞的递送,而两种细胞均被认为是STING激动剂的关键应答者。
杨振军团队近年来发展了核苷(酸)脂材/肽类阳离子脂材,包载各类功能寡核苷酸,实现了siRNA、ASO、核酸适配体和mRNA及环二核苷酸的体外高效细胞转染及体内递送(Biomaterials, 2018, 2019; Mol Ther Nucleic Acid, 2021, 2023; RSC Med Chem, 2024; J Control Release, 2021; Thranostics, 2022; Eur J Med Chem, 2023),特别是实现了肝以外胰腺癌组织的靶向递送(Biomed Pharmacother, 2024)。该类制剂的制备简单方便,不依赖微流控技术,体内未见毒副作用。
该项工作介绍了一类新型原位肿瘤疫苗,由Bis-2'-F-cGSASMP异构体(FGA-di-pS-2 或FGA-di-pS-4和胞苷脂材(DNCA)/肽类阳离子脂材(CLD)(Mix)构成,旨在通过有效向细胞内递送STING激动剂-化学修饰的环二核苷酸,诱导肿瘤细胞免疫原性细胞死亡(ICD),导致全肿瘤相关抗原的暴露和呈递,重编程肿瘤TME,刺激抗肿瘤免疫,抑制肿瘤生长和提高荷瘤小鼠生存率。
FGA-di-pS-2/Mix和FGA-di-pS-4/Mix(结构如图1A)显著降低了肺肿瘤细胞的活力并诱导凋亡(图1 B-E)。细胞表面钙网蛋白(CRT)表达和三磷酸腺苷(ATP)释放是ICD的标志,在A549和LLC细胞中均显著上调(图1F-I),表明FGA-di-pS-2/Mix和FGA-di-pS-4/Mix在所示癌细胞系中都触发了强效ICD。
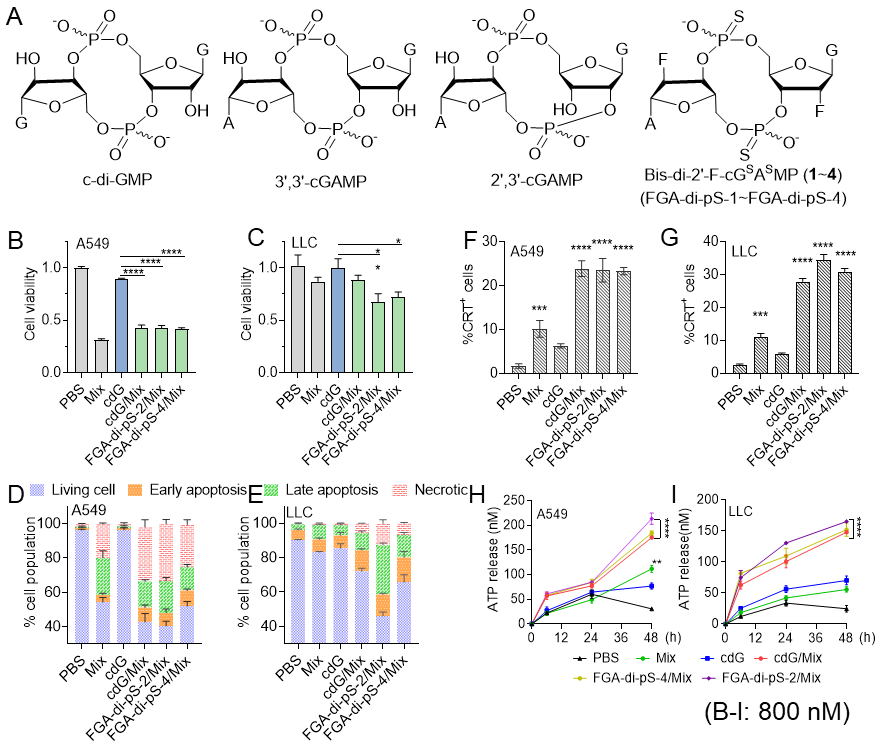
图1 STING激活可诱导肺癌细胞发生免疫原性死亡。A. 内源性CDNs和该团队制备的Bis-2'-F-cGSASMP(1-4)异构体的化学结构; B,C. A549和LLC细胞在不同剂型作用24 h后的凋亡定量(one-way ANOVA); D,E. 给药后24 h时A549和LLC细胞凋亡的定量分析。F,G. 给药24小时后A549和LLC细胞表面钙网蛋白(CRT)的流式细胞术分析; H,I. 给药后6、24和48小时A549和LLC细胞的ATP释放; n = 3。
基于制剂在体外诱导ICD的能力,在LLC小鼠模型中进一步探索了它们作为原位自体疫苗的治疗效果(图2 A)。FGA-di-pS-2(1 µg)/Mix抑瘤效果最佳,优于FGA-di-pS-2(5 µg)/Mix。在FGA-di-pS-4/Mix和FGA-di-pS/Mix组中也观察到类似的结果,2 µg剂量的FGA-di-pS/Mix抑制肿瘤生长的作用大于5 µg剂量。结果表明疫苗的抗肿瘤免疫效果与剂量密切相关,提示应用这类药物时应首先确定合适的剂量。选择临床试验候选药物ADU-S100(NCT02675439)作为对照。FGA-di-pS-2/Mix(1 µg)组小鼠肿瘤体积远低于ADU-S100(20 µg)和ADU-S100/Mix(1 µg)组(图2 B和D)。此外,FGA-di-pS-2/Mix(1 µg)和FGA-di-pS/Mix(2 µg)给药组小鼠的肿瘤消退率分别为100%(10/10)和30%(3/10)(图2 B-D)。
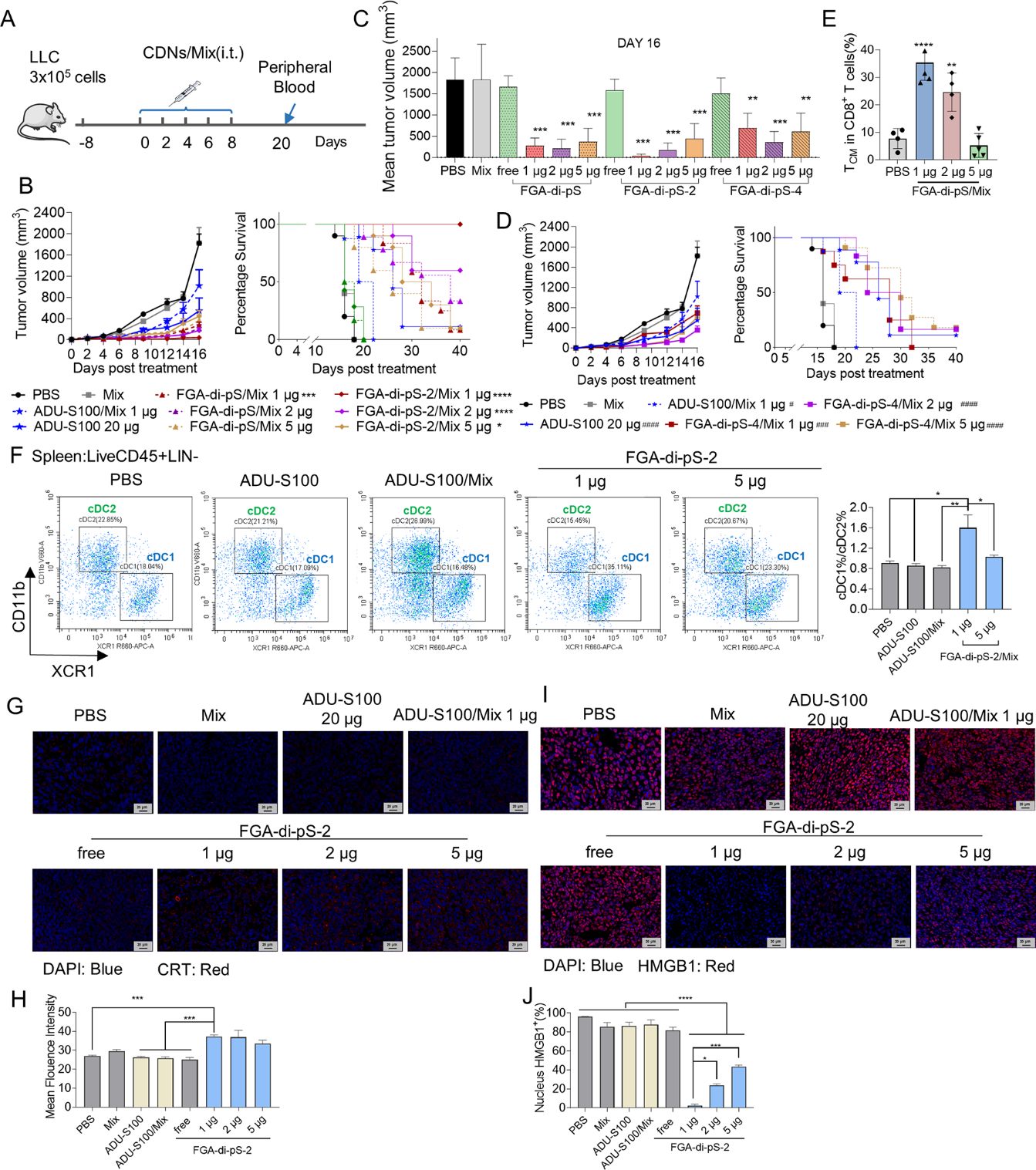
图2 FGA-di-pS-2/Mix 和 FGA-di-pS-4/Mix 抑制了 LLC 小鼠模型中的肿瘤生长。A. 治疗方案; B,D. 用指定制剂治疗的小鼠的平均肿瘤体积和生存曲线(n = 10); C. 治疗后第16天用指定制剂治疗的小鼠的平均肿瘤体积; E. 流式细胞术定量小鼠外周血中CD8+TCM细胞比例; F. 用指定制剂(n = 5)处理的小鼠脾脏中cDC1%/cDC2%比率的代表性散点图和定量; G,H. 荧光显微镜图像和CRT表达的定量(DAPI:蓝色,CRT:红色,80×, 刻度20 μm,n = 3); I,J. 荧光显微镜图像和HMGB1表达的定量(DAPI: 蓝色,HMGB1:红色,80×,刻度20 μm,n = 3); 显著性表示与PBS(#)或ADU-S100/Mix(∗)相比的水平。
为了研究FGA-di-pS-2/Mix是否能在体内诱导ICD,检测了不同治疗组中DAMPs的表达和释放。如图2 G所示,FGA-di-pS-2/Mix组(1、2、5 µg)在LLC细胞膜表面有CRT的高表达。还通过荧光显微镜观察到HMGB1蛋白的释放。正常情况下,HMGB1蛋白定位于细胞核;相应的,PBS组、Mix组、free ADU-S100组和ADU-S100/Mix组的细胞核中有大量的红色荧光,而FGA-di-pS-2/Mix组(1、2、5 µg)由于ICD引起HMGB1蛋白大量释放,细胞核中只有少量的HMGB1蛋白表达(图2 I)。
此外,治疗后的荷瘤小鼠表现出强大的免疫记忆效应,对肿瘤的再挑战表现出100%的保护作用。该疫苗有效促进DC成熟并向cDC1分化、M1型巨噬细胞极化和CD8+T细胞活化等,还能降低肿瘤微环境中发挥免疫抑制作用的Treg细胞的比例,肿瘤疫苗显示出良好的效果。该制剂更广泛深入的机制研究正在进行中,未来有望成为个体化的肿瘤疫苗,并可能联合mRNA等制剂开展疾病治疗研究工作。

博士研究生 于晶、博士后 于小桐
杨振军教授团队博士研究生于晶和博士后于小桐为该论文的共同第一作者,杨振军教授为通讯作者。以上研究得到了中国科学技术部新药重大专项(2017ZX09303013)、国家自然科学基金委和河南省联合基金重点项目(U1604285)和国家自然科学基金委面上项目(21572013)的支持。
论文链接:https://www.sciencedirect.com/science/article/pii/S1525001624002405?via%3Dihub
【杨振军教授简介】

杨振军,北京大学医学部药学院教授、天然药物及仿生药物全国重点实验室PI。1987年获得北京医科大学药学专业学士学位,1998年在该校获药物化学专业理学博士学位, 2000-2002年在美国佐治亚大学药学院从事博士后研究, 2008年起任现职。曾任国家自然科学基金委员会化学学部化学生物学流动项目主任及本院药物化学系副主任,现任中国化学会化学生物学和中国药学会药物化学专业委员会委员。主要研究方向:1. 核酸药物的化学修饰和新型靶向制剂研究;2. 基于核酸适配体的疾病早期检测新技术研究;3. 环核苷酸类信使分子化学生物学研究。发表研究论文160多篇,申请和授权专利30余项。负责科技部新药重大专项、973项目课题、重大863项目课题、国家自然科学基金委重点课题子课题和面上课题多项。曾获教育部自然科学一等奖一项、二等奖两项,国家自然科学二等奖一项。